帕金森病 震顫麻痹 特發性帕金森病 PD
帕金森病 震顫麻痹 特發性帕金森病 PD百科
帕金森病又稱特發性帕金森病(idiopathicParkinson`sdisease,PD),簡稱Parkinson病,也稱為震顫麻痹(paralysisagitans,shakingpalsy),是中老年人常見的神經系統變性疾病,也是中老年人最常見的錐體外系疾病,主要病變在黑質和紋狀體通路,多巴胺生成減少.65歲以上人群患病率為1000/10萬,隨年齡增高,男性稍多於女性.
帕金森病 震顫麻痹 特發性帕金森病 PD
帕金森病 震顫麻痹 特發性帕金森病 PD病因
年齡老化(25%):
帕金森主要發生於中老年人,40歲以前發病少見,提示老齡與發病有關,研究發現,自30歲以後,黑質多巴胺能神經元,酪氨酸氧化酶和多巴脫羧酶活力,紋狀體多巴胺遞質水平隨年齡增長逐漸減少,然而,僅少數老年人患此病,說明生理性多巴胺能神經元蛻變不足以致病,年齡老化隻是本病發病的促發因素.
環境因素和遺傳易患性(5%):
流行病學調查結果發現,帕金森病的患病率存在地區差異,所以人們懷疑環境中可能存在一些有毒的物質,損傷瞭大腦的神經元.遺傳易患性,近年在傢族性帕金森病患者中曾發現a共同核素基因的Alα53THr突變,但以後多次未被證實.
傢族遺傳性(35%):
醫學傢們在長期的實踐中發現帕金森病似乎有傢族聚集的傾向,有帕金森病患者的傢族其親屬的發病率較正常人群高一些.特發性帕金森病(idiopathicParkinson`sdisease)病因迄今未明,某些中樞神經系統變性疾病伴Parkinson病癥狀,以中樞神經系統不同部位變性為主,尚有其他臨床特點,故可稱之為癥狀性Parkinson病,如進行性核上性麻痹(PSP),紋狀體黑質變性(SND),Shy-Drager綜合征(SDS)及橄欖腦橋小腦萎縮(OPCA)等,還有一些疾病或因素可以產生類似PD臨床癥狀,其病因為感染,藥物(多巴胺受體阻滯藥等),毒物(MPTP,一氧化碳,錳等),血管性(多發性腦梗死)及腦外傷等所致,臨床上稱為帕金森綜合征(Parkinson`ssyndrome,Palkinsonism).
目前普遍認為,帕金森並非單一因素,多種因素可能參於其中,遺傳因素可使患病易感性增加,隻有與環境因素及衰老的相互作用下,通過氧化應激,線粒體功能衰竭,鈣超載,興奮性氨基酸毒性作用,細胞凋亡,免疫異常等機制才導致黑質多巴胺能神經元大量變性丟失而發病.
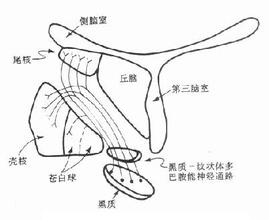
病理改變主要病變是含色素神經元變性,缺失,黑質致密部DA能神經元最顯著,鏡下可見神經細胞減少,黑質細胞黑色素消失,黑色素顆粒遊離散佈於組織和巨噬細胞內,伴不同程度神經膠質增生,正常人黑質細胞隨年齡增長而減少,黑質細胞80歲時從原有42.5萬減至20萬個,PD患者少於10萬個,出現癥狀時DA能神經元丟失50%以上,藍斑,中縫核,迷走神經背核,蒼白球,殼核,尾狀核及丘腦底核等也可見輕度改變.
殘留神經元胞漿中出現嗜酸性包涵體路易(Lewy)小體是本病重要病理特點,Lewy小體是細胞漿蛋白質組成的玻璃樣團塊,中央有致密核心,周圍有細絲狀暈圈,一個細胞有時可見多個大小不同的Lewy小體,見於約10%的殘存細胞,黑質明顯,蒼白球,紋狀體及藍斑等亦可見,α-突觸核蛋白和泛素是Lewy小體的重要組分.
神經生化改變:DA和乙酰膽堿(Ach)作為紋狀體兩種重要神經遞質,功能相互拮抗,維持兩者平衡對基底節環路活動起重要調節作用,腦內DA遞質通路主要為黑質-紋狀體系,黑質致密部DA能神經元自血流攝入左旋酪氨酸,在細胞內酪氨酸羥化酶(TH)作用下形成左旋多巴(L-dopa);再經多巴胺脫羧酶(DDC)作用生成多巴胺(DA);通過黑質-紋狀體束,DA作用於殼核,尾狀核突觸後神經元,最後被分解成高香草酸(HVA).
由於特發性帕金森病TH和DDC減少,使DA生成減少(左旋酪氨酸生成L-dopa減少,DA生成減少),單胺氧化酶B(MAO-B)抑制可劑減少神經元內DA分解代謝,增加腦內DA含量,兒茶酚-氧位-甲基轉移酶(COMT)抑制劑能減少L-dopa外周代謝,維持L-dopa穩定的血漿濃度.
患者黑質DA能神經元變性丟失,黑質-紋狀體DA通路變性,紋狀體DA含量顯著降低(>80%),使Ach系統功能相對亢進,是導致肌張力增高,動作減少等運動癥狀的生化基礎,近年發現中腦-邊緣系統和中腦-皮質系統DA含量亦顯著減少,可能導致智能減退,行為情感異常,言語錯亂等高級神經活動障礙,DA遞質減少程度與患者癥狀嚴重度一致,病變早期通過DA更新率增加(突觸前代償)和DA受體失神經後超敏現象(突觸後代償),臨床癥狀可不明顯(代償期),隨疾病進展出現典型PD癥狀(失代償期),基底節其他遞質或神經肽,如去甲腎上腺素(NE),5-羥色胺(5-HT),P物質(SP),腦啡肽(ENK),生長抑素(SS)也有變化.
帕金森病 震顫麻痹 特發性帕金森病 PD
帕金森病 震顫麻痹 特發性帕金森病 PD症状
帕金森病的癥狀步態異常齒輪樣強直感覺障礙功能性震顫關節疼痛慌張步態肌肉萎縮肌痛靜止性震顫開瞼及閉瞼失用臨床前期癥狀最早提出臨床前期癥狀僅見於Fletcher(1973)等人的報告,但他們提出的這些癥狀至今尚未得到人們的重視,這些癥狀主要包括以下兩方面:
感覺異常:主要表現為患肢關節處無緣由的麻木,刺痛,蟻行感和燒灼感,以腕,踝處為主,開始多為間歇性或遊走性,後期表現為固定性,常規神經系統查體無明顯客觀感覺異常,電生理檢查可見部分病例的體感誘發電位(SEP),特別是下肢的潛伏期和傳導時間延長,到20世紀90年代初,我們對150例患者作瞭回顧性調查,結果是全部患者不同程度的在PD臨床癥狀出現前體驗過患肢感覺異常,而且這種異常可一直持續下去,但與運動障礙不成平行關系,電生理檢查主要是體感,皮質誘發電位有皮質延擱(centredelay)和傳導延遲及潛伏期延長.
不寧肢與易疲憊:除主觀感覺異常外,約1/2患者在早期曾體驗過患肢難以描述的酸,脹,麻木或疼痛等不適感,而且這種不適感多在勞累後的休息時發生或明顯,經敲,捶打後可緩解,酷像不寧腿綜合征的表現,另則,部分患者的患肢易出現疲勞感,特別是上肢的腕關節,肩關節,下肢的踝關節和膝關節,當勞累後這些部位可出現難以發現的輕微震顫,對這些癥狀開始時服用一般鎮痛藥可有效,數月後則無作用,此時服用多巴藥物後可出現明顯療效.
臨床期癥狀首發癥狀存在著明顯個體差異,有報告統計主觀感覺異常為85%,震顫為70.5%,肌僵直或動作緩慢為19.7%,失靈巧和(或)寫字障礙為12.6%,步態障礙為11.5%,肌痛痙攣和疼痛為8.2%,精神障礙如抑鬱和焦慮緊張等為4.4%,語言障礙為3.8%,全身乏力或肌無力為2.7%,流口水和面具臉各為1.6%.
靜止性震顫(statictremor):常為PD首發癥狀,少數患者尤其70歲以上發病者可不出現震顫,其機制是受累肌群與拮抗肌群規律性,交替性不協調活動所致,早期常表現在肢體遠端,始於一側,以上肢的手部震顫為多見,部分患者始於下肢的膝部,當伴有旋轉的成分參與時,可出現拇指,示指搓丸樣震顫,震顫頻率一般在4~8Hz,靜止時出現,大力動作時停止,緊張時加劇,睡眠時消失,經數年後累及到同側上下肢或對側,嚴重者可出現頭部,下頜,口唇,舌,咽喉部以及四肢震顫,令患者活動一側肢體如握拳或松拳,可引起另側肢體出現震顫,該試驗有助於發現早期輕微震顫,後期除靜止性震顫外,部分患者可合並動作性或姿勢性震顫.
肌強直(rigidity):肌強直是PD的主要癥狀之一,主要是由於主動肌和拮抗肌均衡性張力增高所致,如果在被動運動中始終存在,則被稱之為“鉛管樣強直或張力",若同時伴有震顫時,被動運動時可感到有齒輪樣感覺,則稱之為“齒輪樣強直或張力",肌強直最早發生在患側的腕,踝,特別是患者勞累後,輕緩的被動運動腕,踝關節時可感到齒輪樣肌張力增高,由於肌張力的增高,可給患者帶來一系列的異常癥狀,如瞬目,咀嚼,吞咽,行走等動作減少.
以下臨床試驗有助於發現輕微肌強直:①令患者運動對側肢體,被檢肢體肌強直可更明顯,②頭墜落試驗(headdroppingtest):患者仰臥位,快速撤離頭下枕頭時頭常緩慢落下,而非迅速落下,③令患者把雙肘置於桌上,使前臂與桌面成垂直位,兩臂及腕部肌肉盡量放松,正常人此時腕關節與前臂約成90°屈曲,PD患者腕關節或多或少保持伸直,儼若豎立的路標,稱為“路標現象",老年患者肌強直引起關節疼痛,是肌張力增高使關節血供受阻所致.
運動遲緩(bradykinesia):表現隨意動作減少,包括始動困難和運動遲緩,因肌張力增高,姿勢反射障礙出現一系列特征性運動障礙癥狀,如起床,翻身,步行和變換方向時運動遲緩,面部表情肌活動減少,常雙眼凝視,瞬目減少,呈面具臉(maskedface),手指精細動作如扣紐扣,系鞋帶等困難,書寫時字愈寫愈小,為寫字過小征(micrographia)等.
患者的運動緩慢或不能是致殘的主要原因,過去認為PD的運動不能是由於肌強直所致,事實上兩者並無因果關系,現已初步證明,PD的運動減少和不能是一個很復雜的癥狀,它主要和皮質下錐體外系的驅動裝置功能或錐體外系下行運動激活裝置障礙有關,因為對運動不能的患者進行手術治療後,肌強直癥狀明顯改善,但其運動頻度並非像服用多巴藥物後成一致性改善.
姿勢步態異常:姿勢反射障礙是帶給PD患者生活困難的主要癥狀,它僅次於運動減少或運動不能,患者四肢,軀幹和頸部肌強直呈特殊屈曲體姿,頭部前傾,軀幹俯屈,上肢肘關節屈曲,腕關節伸直,前臂內收,指間關節伸直,拇指對掌;下肢髖關節與膝關節均略呈彎曲,早期下肢拖曳,逐漸變為小步態,起步困難,起步後前沖,愈走愈快,不能及時停步或轉彎,稱之為“慌張步態"(festination),行走時上肢擺動減少或消失,轉彎時因軀幹僵硬,軀幹與頭部聯帶小步轉彎,與姿勢平衡障礙導致重心不穩有關,患者害怕跌倒,遇小障礙物也要停步不前,隨疾病進展姿勢障礙加重,晚期自坐位,臥位起立困難,目前對PD患者這種固有的姿勢反射障礙的機制尚無明確解釋,有人認為該癥狀主要與蒼白球經丘腦至皮質的傳出環路損害有關.
其他癥狀:
①反復輕敲患者眉弓上緣可誘發眨眼不止(Myerson征),正常人反應不持續;可有眼瞼陣攣(閉合眼瞼輕度顫動)或眼瞼痙攣(眼瞼不自主閉合).
②口,咽,腭肌運動障礙,使講話緩慢,語音低沉單調,流涎等,嚴重時吞咽困難.
③常見皮脂腺,汗腺分泌亢進引起脂顏(oilyface),多汗,消化道蠕動障礙引起頑固性便秘,交感神經功能障礙導致直立性低血壓等,括約肌功能不受累.
④精神癥狀以抑鬱多見,可出現焦慮,激動,部分患者晚期出現輕度認知功能減退,視幻覺,通常不嚴重.

帕金森病 震顫麻痹 特發性帕金森病 PD
帕金森病 震顫麻痹 特發性帕金森病 PD检查
帕金森病檢查項目染色體尿銅谷氨酸銅藍蛋白血壓腦葡萄糖代謝顯像實驗室檢查血清腎素活力降低,酪氨酸含量減少;黑質和紋狀體內NE,5-HT含量減少,谷氨酸脫羧酶(GAD)活性較對照組降低50%.
中GABA下降,CSF中DA和5-HT的代謝產物HVA含量明顯減少.
生化檢測:放免法檢測CSF生長抑素含量降低,尿中DA及其代謝產物3-甲氧酪胺,5-HT和腎上腺素,NE也減少.
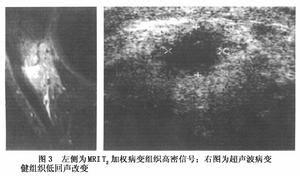
影像學檢查,MRI影像表現由於帕金森病是一種中樞神經系統退性變疾病,病理變化主要在黑質,紋狀體,蒼白球,尾狀核以及大腦皮質等處,所以,CT影像表現,除具有普遍性腦萎縮外,有時可見基底節鈣化,MRI除能顯示腦室擴大等腦萎縮表現外,T2加權像在基底節區和腦白質內常有多發高信號斑點存在.
影像表現通過多巴胺受體(DAR)的功能影像:多巴胺受體廣泛分佈於中樞神經系統中多巴胺能通路上,其中主要是黑質,紋狀體系統,DAR(DL)分佈於紋狀體非膽堿能中間神經元的胞體;DAR(D2)位於黑質,紋狀體多巴胺能神經元胞體.
是將放射性核素,目前主要是123I-IBZM,131I-IBZM,特異性D2受體標記物,靜脈註入人體後,通過在基底節區域的放射活性與額葉,枕葉或小腦放射活性的比值,反映DAR受體數目和功能,來診斷早期帕金森病,如果早期采用多巴制劑治療患者,起病對側腦DAR(D2)上調,長期服用多巴制劑的中晚期帕金森病患者,腦中基底節/枕葉和基底節/額葉比值減少,SPECT功能影像隻能檢測DAR受體數目,不能幫助確診是否為原發性帕金森病,但是可以區別某些繼發性帕金森病,還可用作帕金森病病性演變和藥物治療效果指標.
通過多巴胺轉運蛋白(DAT)功能顯像:多巴胺轉運蛋白(DAT)如何轉運多巴胺(DA)尚不清楚,DAT主要分佈於基底節和丘腦,其次為額葉,DAT含量與帕金森病的嚴重程度是存在著正相關性,基底節DAT減少,在早期帕金森病患者表現很顯著.
采用11C-WIN35428,123Iβ-CIT,通過靜脈註入人體後,檢測基底節/小腦活性比值以及丘腦/小腦活性比值,反映中樞不同區域DAT數量,早期帕金森病患者,基底節區域DAT數目明顯減少.
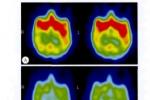
功能影像正電子發射斷層掃描(PET)診斷帕金森病,其工作原理和方法與SPECT基本相似,目前主要是依賴腦葡萄糖代謝顯像,一般采用18F脫氧葡萄糖(18FDG),因為在帕金森病病人早期,紋狀體局部葡萄糖代謝率就中度降低,晚期葡萄糖代謝率進一步降低,用PET的受體顯像劑很多,PET神經遞質功能顯像劑主要是用18F-多巴-PET(18FD-PET)等核素,基本原理同SPECT,PET可對帕金森病進行早期診斷,可作帕金森病高危人群中早期診斷,是判斷病情嚴重程度的一種客觀指標.
帕金森病 震顫麻痹 特發性帕金森病 PD预防
一級預防(無病防病、對有帕金森病傢族史及有關基因攜帶者,有毒化學物品接觸者,均應視為高危人群,須密切監護隨訪,定期體檢,並加強健康教育,重視自我防護.
1、加大工農業生產環境保護的力度,減少有害氣體,污水,污物的排放,對有害作業人員應加強勞動防護.
2、改善廣大農村及城鎮的飲水設施,保護水資源,減少河水,庫水,塘水及井水的污染,保證廣大人民群眾能喝上安全衛生的飲用水.
3、老年人慎用吩噻嗪類,利血平類及丁酰苯類藥物.
4、重視老年病(高血壓,高血脂,高血糖,腦動脈硬化等)的防治,增強體質,延緩衰老,防止動脈粥樣硬化,對預防帕金森病均能起到一定的積極作用.
二級預防(早發現,早診斷,早治療、早期診斷,帕金森病的亞臨床期長,若能即早開展臨床前期診斷技術,如嗅覺機能障礙,PET掃描,線粒體DNA,多巴胺抗體,腦脊液化學,電生理等檢查,將亞臨床期帕金森病盡早發現,采用神經保護劑(如維生素E,SOD,谷胱甘肽及谷胱甘肽過氧化物酶,神經營養因子,塞利吉林)治療,可能會延緩整個臨床期的過程.
1、帕金森病早期,雖然黑質和紋狀體神經細胞減少,但多巴胺分泌卻代償性增加,此時腦內多巴胺含量並未明顯減少,稱代償期,一般不主張用藥物治療,可采用理療,醫療體育,太極拳,水療,按摩,氣功,針灸等治療,以維持日常一般工作和生活,盡量推遲抗震顫麻痹藥物應用的時間,但也有人主張早期應用小劑量左旋多巴以減少並發癥,這要因人而異用藥物治療.
三級預防(延緩病情發展,防止病殘,改善生活質量、積極進行非藥物如理療,體療,針灸,按摩等及中西醫藥物或手術等綜合治療,以延緩病情發展.
1、重視心理疏導安撫和精神關愛,保證充足睡眠,避免情緒緊張激動,以減少肌震顫加重的誘發因素.
2、積極鼓勵患者主動運動,如吃飯,穿衣,洗漱等,有語言障礙者,可對著鏡子努力大聲地練習發音,加強關節,肌力活動及勞作訓練,盡可能保持肢體運動功能,註意防止摔跤及肢體畸形殘廢.
3、長期臥床者,應加強生活護理,註意清潔衛生,勤翻身拍背,防止墜積性肺炎及褥瘡感染等並發癥,帕金森病大部分死於肺部或其他系統如泌尿系統等的感染,註意飲食營養,必要時給予鼻飼,保持大小便通暢,以不斷增強體質,提高免疫功能,降低死亡率.
帕金森病 震顫麻痹 特發性帕金森病 PD治疗
帕金森病西醫治療方法早期治療早期黑質-紋狀體系統存留的DA神經元可代償地增加DA合成,推薦采用理療(按摩、水療)和體育療法(關節活動、步行、平衡及語言鍛煉、面部表情肌操練)等,爭取患者傢屬配合,鼓勵患者多主動運動,盡量推遲藥物治療時間.若疾病影響患者日常生活和工作,需藥物治療.
藥物治療目前仍以藥物治療為主,恢復紋狀體DA與Ach遞質系統平衡,應用抗膽堿能和改善DA遞質功能藥物,改善癥狀,不能阻止病情發展.
用藥原則:
①從小劑量開始,緩慢遞增,盡量用較小劑量取得滿意療效.
②治療方案個體化,根據患者年齡、癥狀類型和程度、就業情況、藥物價格和經濟承受能力等選擇藥物.
③不應盲目加用藥物,不宜突然停藥,需終生服用.
④PD藥物治療復雜,近年來推出的輔助藥物DR激動藥、MAO-B抑制劑、兒茶酚-氧位-甲基轉移酶(COMT)等,與復方多巴合用可增強療效、減輕癥狀波動、降低復方多巴劑量,單獨使用療效不理想,應權衡利弊,適當選擇聯合用藥.
抗膽堿能藥:對震顫和強直有效,對運動遲緩療效較差,適於震顫明顯年齡較輕患者.常用安坦(artane)1~2mg口服,3次/d,開馬君(kemadrin)2.5mg口服,3次/d,逐漸增至20~30mg/d.其他如苯甲托品(cogentin)、環戊丙醇(cycrimine)、安克痙(akineton)等,作用與安坦相似.副作用包括口幹、視物模糊、便秘和排尿困難,嚴重者有幻覺、妄想.青光眼及前列腺肥大患者禁用,可影響記憶功能,老年患者慎用.
金剛烷胺(amantadine):促進DA在神經末梢釋放,阻止再攝取,並有抗膽堿能作用,是谷氨酸拮抗藥,可能有神經保護作用,可輕度改善少動、強直和震顫等,早期可單獨或與安坦合用.起始劑量50mg,2~3次/d,1周後增至100mg,2~3次/d,一般不超過300mg/d,老年人不超過200mg/d.藥效可維持數月至1年.副作用較少,如不安、意識模糊、下肢網狀青斑、踝部水腫和心律失常等,腎功能不全、癲癇、嚴重胃潰瘍和肝病患者慎用,哺乳期婦女禁用.也可用其衍生物鹽酸美金剛烷(memantinehydrochloride).
左旋多巴(L-dopa)及復方左旋多巴:L-dopa是治療PD有效藥物或金指標.作為DA前體可透過血腦屏障,被腦DA能神經元攝取後脫羧變為DA,改善癥狀,對運動減少有特殊療效.由於95%以上的L-dopa在外周脫羧成為DA,僅約1%通過BBB進入腦內,為減少外周副作用,增強療效,多用L-dopa與外周多巴脫羧酶抑制劑(DCI)按4∶1制成的復方制劑(復方L-dopa),用量較L-dopa減少3/4.
復方L-dopa劑型:包括標準片、控釋片、水溶片等.標準片如美多巴(madopar)和帕金寧(sinemet):①Madopar由L-dopa與芐絲肼按4∶1組成,美多巴250為L-dopa200mg+芐絲肼50mg,美多巴125為L-dopa100mg+芐絲肼25mg;國產多巴絲肼膠囊成分與美多巴相同;②帕金寧(Sinemet250和Sinemet125)由L-dopa與卡別多巴按4∶1組成.
控釋劑包括兩種:
①息寧控釋片(sinemetCR):L-dopa200mg+卡別多巴50mg,制劑中加用單層分子基質結構,藥物不斷溶釋,達到緩釋效果,口服後120~150min達到血漿峰值濃度,片中間有刻痕,可分為半片服用,保持緩釋特性.
②美多巴液體動力平衡系統(Madopar-HBS):L-dopa100mg+芐絲肼25mg及特殊賦形劑組成,膠囊溶解時藥物基質表面形成水化層,通過彌散作用逐漸釋放.
水溶片有彌散型美多巴(madopardispersible),劑量為125mg,由L-dopa100mg+芐絲肼25mg組成.其特點易在水中溶解,便於口服,吸收迅速,很快達到治療閾值濃度,使處於“關閉"狀態的PD患者在短時間內(10min左右)迅速改善癥狀,且作用維持時間與標準片基本相同.該劑型適用於有吞咽障礙或置鼻飼管、清晨運動不能、“開"期延遲、下午“關"期延長、劑末肌張力障礙的PD患者.
用藥時機:何時開始復方L-dopa治療尚有爭議,長期用藥會產生療效減退、癥狀波動及運動障礙等並發癥.一般應根據患者年齡、工作性質、疾病類型等決定用藥.年輕患者可適當推遲使用,早期盡量用其他抗PD藥,患者因職業要求不得不用L-dopa時應與其他藥物合用,減少復方L-dopa劑量.年老患者可早期選用L-dopa,因發生運動並發癥機會相對較少,對合並用藥耐受性差.
用藥方法:從小劑量開始,根據病情逐漸增量,用最低有效量維持.
①標準片:復方L-dopa開始用62.5mg(1/4片),2~3次/d,根據需要逐漸增至125mg,3~4次/d;最大劑量不超過250mg,3~4次/d;空腹(餐前1h或餐後2h)用藥療效好.
②控釋片:優點是減少服藥次數,有效血藥濃度穩定,作用時間長,可控制癥狀波動;缺點是生物利用度較低,起效緩慢,標準片轉換成為控釋片時每天劑量應相應增加並提前服用,適於伴癥狀波動或早期輕癥患者.
③水溶片:易在水中溶解,吸收迅速,10min起效,作用維持時間與標準片相同,適於吞咽障礙、清晨運動不能、“開關"現象和劑末肌張力障礙患者.
副作用:周圍性副作用常見惡心、嘔吐、低血壓和心律失常(偶見)等,用藥後可逐漸適應,餐後服藥、加用嗎叮啉可減輕消化道癥狀.中樞性副作用包括癥狀波動、運動障礙和精神癥狀等,癥狀波動和運動障礙是常見的遠期並發癥,多在用藥4~5年後出現.閉角型青光眼、精神病患者禁用.
受體激動藥:DA包括五種類型受體,D1R和D2R亞型與PD治療關系密切.DR激動藥共同作用特點是:①直接刺激紋狀體突觸後DR,不依賴於DDC將L-dopa轉化為DA發揮效應;②血漿半衰期(較復方多巴)長,③可能對黑質DA能神經元有保護作用.早期DR激動藥與復方多巴合用,不僅能提高療效,減少復方多巴用量,且可減少或避免癥狀波動或運動障礙發生.
適應證:PD後期患者用復方多巴治療產生癥狀波動或運動障礙,加用DR激動藥可減輕或消除癥狀,減少復方多巴用量.疾病後期因黑質紋狀體DA能系統缺乏DDC,不能把外源性L-dopa脫羧轉化為DA,用復方多巴完全無效,用DR激動藥可能有效.單用DA受體激動藥療效不佳,一般主張與復方L-dopa合用,發病年齡輕的早期患者可單獨應用.應從小劑量開始,漸增量至獲得滿意療效而不出現副作用.副作用與復方L-dopa相似,癥狀波動和運動障礙發生率低,體位性低血壓和精神癥狀發生率較高.
常用制劑:主要是溴隱亭、培高利特.
①溴隱亭(bromocriptine):激活D2受體,開始0.625mg/d,每隔3~5天增加0.625mg,通常治療劑量7.5~15mg/d,分3次服;副作用與左旋多巴類似,錯覺和幻覺常見,精神病史患者禁用,相對禁忌證包括近期心肌梗死、嚴重周圍血管病和活動性消化性潰瘍等.
②培高利特(pergolide):激活D1和D2兩類受體,開始0.025mg/d,每隔5天增加0.025mg,一般有效劑量0.375~1.5mg/d,最大不超過2.0mg/d,1~3h達血漿峰值濃度,半衰期較長(平均30h),較溴隱亭抗PD作用稍強,作用時間亦長,溴隱亭治療無效時改用培高利特可能有效.
③泰舒達緩釋片(trastalSR):化學成分為吡貝地爾,是選擇性D2/D3多巴胺受體激動藥,劑量為150~250mg/d,對中腦-皮質和邊緣葉通路D3R有激動效應,改善震顫作用明顯,對強直和少動也有作用.
④麥角乙脲(lisuride):具有較強選擇性D2R激動作用,對D1R作用很弱,從小劑量開始,0.05~0.1mg/d,逐漸增量,平均有效劑量為2.4~4.8mg/d;按作用-劑量比,作用較溴隱亭強10~20倍,半衰期短(平均2.2h),作用時間短,為水溶性,可靜脈或皮下輸註泵應用,用於復方多巴治療出現明顯“開-關"現象.
⑤阿樸嗎啡(apomorphine):D1和D2R激動藥,可顯著減少“關期"狀態,對癥狀波動,尤其“開-關"現象和肌張力障礙有明顯療效,采取筆式註射法給藥後5~15min起效,有效作用時間60min,每次給藥0.5~2mg,每天可用多次,便攜式微泵皮下持續灌註法可使患者每天保持良好運動功能;也可經鼻腔給藥,但長期用藥可刺激鼻黏膜.
⑥卡麥角林(cabaser):是所有DR激動藥中半衰期最長(70h),作用時間最長,適於PD後期長期應用復方多巴產生癥狀波動和運動障礙患者,有效劑量2~10mg/d,平均4mg/d,隻需1次/d,較方便.
⑦普拉克索(Pramipexole,0.125mg,3次/d,逐漸加量至0.5~1.0mg,3次/d)和羅吡尼洛(Ropinirole,0.25mg,3次/d,逐漸加量至2~4mg,3次/d),均非麥角衍生物,無麥角副作用,用於早期或進展期PD,癥狀波動和運動障礙發生率低,常見意識模糊、幻覺及直立性低血壓.
單胺氧化酶B(MAO-B)抑制劑:抑制神經元內DA分解,增加腦內DA含量.合用復方L-dopa有協同作用,減少L-dopa約1/4用量,延緩開關現象,有神經保護作用.常用思吉寧(selegiline)即丙炔苯丙胺(deprenyl)2.5~5mg,2次/d,宜早、午服用,傍晚服用可引起失眠.副作用有口幹、胃納少和體位性低血壓等,胃潰瘍患者慎用.Lazabemide(Ro19-6327)亦系MAO-B抑制劑,目前臨床應用報道不多.
兒茶酚-氧位-甲基轉移酶(COMT)抑制劑:抑制L-dopa外周代謝,維持L-dopa穩定血漿濃度,加速通過BBB,阻止腦膠質細胞內DA降解,增加腦內DA含量.與美多巴或息寧合用增強後者療效,減少癥狀波動反應,單獨使用無效.副作用可有腹瀉、頭痛、多汗、口幹、轉氨酶升高、腹痛、尿色變淺等,用藥期間須監測肝功能.
常用制劑:
①托可朋(tolcapone):亦名答是美(tasmar),100~200mg口服,3次/d,副作用有腹瀉、意識模糊、運動障礙和轉氨酶升高等,應註意肝臟毒副作用;具有周圍和中樞COMT抑制作用,臨床試驗顯示,應用復方多巴療效減退的69例PD加用托可朋100~150mg,3次/d,療程6個月,有效率98.5%,無明顯毒副作用,可與復方多巴和MAO-B抑制劑合用.
②恩他卡朋(entacapone):亦名珂丹(comtan),是周圍COMT抑制劑,100~200mg口服,5次/d為宜,與托可朋不同的是迄今無嚴重肝功能損害報道.
興奮性氨基酸(EAA)受體拮抗藥及釋放抑制劑:EAA可損害黑質細胞,抑制劑有神經保護作用,可增強L-dopa作用.但目前尚無臨床有效治療的報道.
鐵螯合劑:PD患者黑質Fe2濃度明顯增加,鐵蛋白含量顯著減少.給予鐵螯合劑可降低Fe2濃度,減少氧化反應.目前常用21-氨基類固醇(21-aminosteroide),可通過血腦屏障與Fe2結合,抑制脂質過氧化,對黑質細胞有保護效應.
神經營養因子(neurotrophicfactors):對神經元發育、分化及存活起重要作用,選擇性作用於DA能神經元的神經營養因子有助於PD防治.神經營養因子包括酸性及堿性成纖維細胞生長因子(aFGF、bFGF)、上皮生長因子(EGF)、睫狀神經營養因子(CNTF)、腦源性神經營養因子(BDNF)、膠質細胞源性神經營養因子(GDNF)及Neurturin等.GDNF和Neurturin對中腦DA能神經元特異性強.
中藥或針灸對PD治療有一定的輔佐作用,需與西藥合用,單用療效不理想.
康復治療對患者進行語言、進食、行走及各種日常生活訓練和指導,對改善生活質量十分重要.晚期臥床者應加強護理,減少並發癥發生.康復包括語音語調訓練,面肌鍛煉,手部、四肢及軀幹鍛煉,松弛呼吸肌鍛煉,步態及平衡鍛煉,姿勢恢復鍛煉等.
預後:
是慢性進展性疾病,目前無根治方法,多數患者發病數年仍能繼續工作,也可迅速發展致殘.疾病晚期可因嚴重肌強直和全身僵硬,終至臥床不起.死因常為肺炎、骨折等並發癥.
帕金森病 震顫麻痹 特發性帕金森病 PD饮食
帕金森病食療方(下面資料僅供參考,詳細需要咨詢醫生、棗仁龍眼湯:龍眼肉、炒棗仁各15克.將龍眼肉、炒棗仁加入水煎成汁,再加適量白蜜即成.每日2次,早、晚服用.對久患帕金森氏病、氣血虧虛者有補益作用.
1、沙棘菊花飲:沙棘50克,菊花10克.將沙棘、菊花洗凈後共同煎湯,每日2次,可早、晚服用一次,也可代茶飲.適用於帕金森氏病合並高脂血癥.
2、陳皮砂仁酸棗粥:陳皮5克,砂仁10克,酸棗15克,粳米適量.將砂仁先煮成湯,再放入粳米,酸棗煮成粥後,再放入陳皮,稍混後即可食用.每日2次,早、晚服食.具有鎮靜作用.
3、天麻燉鵪鶉:
材料:鵪鶉一隻,天麻15克.
制作方法:鵪鶉去毛及內臟,將天麻填入其肚內,用線捆住,用水燉熟,加食鹽、味精.
食用方法:去天麻,吃肉喝湯,隔日一次.
4、天麻燉豬腦:
材料:天麻10克,豬腦花100克.
制作方法:將上述材料放入沙鍋內,加水適量,以文火燉一小時左右.
服用方法:調味後喝湯食豬腦花,每日服用一次,或隔日服用一次.
5、枸杞蒸羊腦:
材料:枸杞子50克,羊腦花一具制作方法:將上述材料放入容器,加水適量,加薑末、蔥節、料酒、食鹽、隔水蒸熟後即可食用.
服用方法:每日分兩次吃.
6、天麻魚頭湯:
材料:天麻15克,川芎10克,鮮鯉魚頭1個.
制作方法:將天麻、川芎泡軟後切薄片放入魚頭中,置盤內,加蔥薑,再加適量清水上籠約30分鐘.
食用方法:食魚肉喝湯,隔日一次.
7、枸杞血藤飲:
材料:枸杞子20克,雞血藤15克,紅花5克.
制作方法:取上述材料,加水500毫升,煎至300毫升,將藥液倒入碗中,放黃酒30克.
服用方法:早晚分兩次飲服,每日一劑.
8、核桃黃酒泥:
材料:核桃仁15個,白糖50克.
制作方法:將上述材料放在砂罐或瓷碗中,用搟面杖搗成泥狀,再放入鍋中,加黃酒50毫升,用小火煎煮10分鐘.
服用方法:每日食用兩次.
帕金森病患者飲食宜忌普食:和正常人的飲食基本相同,適用於咀嚼能力尚好的帕金森病病人.
軟食:適用於咀嚼能力和消化能力減低的病人,可采用易消化(消化食品)、易咀嚼、細軟、無刺激的食品.
半流質軟食:適用於咀嚼、吞咽功能受一定限制的病人,可選用面片、稀酸、豆腐腦、蛋羹、雞蛋湯等.
流質:適用於晚期病人,咀嚼、吞咽功能明顯障礙者.如能由口腔進食者要盡量由口腔進食,緩慢以湯匙或奶瓶喂食,防止嗆咳.嚴重病人必要時給予鼻飼.一般選用牛奶、豆漿、米汁、麥乳精、藕粉、肉湯、菜汁等作為鼻飼飲食.)此外,帕金森病患者便秘是很常見的.飲食中給予適量的新鮮蔬菜(蔬菜食品)、水果(水果食品)和蜂蜜(蜂蜜食品)很為必要,既能緩解便秘(便秘食品),又能補充維生素(維生素食品)類.要避免刺激性食物及煙酒等.
多吃谷類和蔬菜瓜果.從谷類中主要能得到碳水化合物、蛋白質、膳食纖維和維生素B等營養,並能獲取身體所需的能量.碳水化合物通常不影響左旋多巴的藥效.
限制蛋白質(蛋白質食品).帕金森氏病患者的熱能攝入以維持正常體重為宜.過度消瘦與肥胖均不利於治療.服用多巴胺治療者宜限制蛋白質攝入量.因為蛋白質可影響多巴胺的治療效果.蛋白質攝入量限制在每日每公斤體重0.8克以下,全日總量約40克~50克.在限制范圍內多選用乳、蛋、肉、豆制品等優質蛋白質.
禁煙酒及刺激性食品,如咖啡、辣椒、芥末、咖喱等.
不吃肥肉、葷油和動物內臟,有助於防止由於飽和脂肪和膽固醇攝入過多給身體帶來的不良影響.飲食中過高的脂肪也會延遲左旋多巴藥物的吸收,影響藥效.
帕金森病 震顫麻痹 特發性帕金森病 PD并发症
1、損傷是帕金森病不可忽視的並發癥,隨著病情的發展,震顫,僵直,協調功能障礙,會逐漸累及運動功能,腳下遇到障礙物時容易跌跤甚至可發生骨折等損傷,冬天結冰及雨天濕滑的路面,廁所及浴室潮濕光滑的瓷磚地板,對於動作遲鈍,步履不穩的帕金森病病人都是危險的場所,要格外小心,避免摔跌.
2、常並發心理障礙和智能減損,尤多見於晚期病人,帕金森病表現的肢體震顫,僵直,動作笨拙以及缺乏面部表情而呈現的面具臉,兼之說話含混不清,語調單一,音量降低,流口水等,使病人感到有失大雅,心理上常有自卑感,不願參加社會活動,不去公共場所,疏於人際交往,在治療中及疾病發展過程中,還可見到失眠,焦慮,抑鬱,癡呆等.
3、由於植物神經功能障礙,導致消化系統並發癥的發生,表現為:①營養障礙和水電解質紊亂,與吞咽困難,飲食減少,液體補充不足有關,吞咽困難是因為咽部肌肉的協調動作發生障礙,咀嚼的速度減慢,其結果是進食緩慢而更長時間地咀嚼,使食物在口腔和咽喉部堆積;如進食過快則可導致噎塞和嗆咳,②食管擴張,假憩室形成,食管擴約肌功能不良,胸骨後有燒灼感,放射學證明有胃,食管返流,③胃排空延遲,有人統計約占55%,表現為餐後飽脹,惡心,嘔吐,④小腸運動功能不良,由此產生腹脹感,放射學檢查提示小腸擴張,⑤結腸功能不良,主要表現為便秘,其高發生率(50%~67%)和頑固性給病人帶來痛苦,使醫生治療棘手,消化系統的各種並發癥有其相同的病理生理基礎,都是由於胃腸平滑肌過度緊張,運動緩慢,相互協調不良所致.
4、感染是對帕金森病構成威脅的並發癥,一般的呼吸道感染,發熱都會使本病癥狀加重,病人由於免疫功能低下,感冒經常發生,也容易罹患支氣管炎,肺炎,胃腸炎等,晚期臥床的病人,完全喪失生活自理能力,不能獨立起坐,甚則不能自行翻身,兼之營養不良,皮膚受壓,常致褥瘡,墜積性肺炎,吸入性肺炎,心功能衰竭是晚期病人常見的並發癥,最終可以導致死亡,尿頻也常成為帕金森病人求醫的原因,尤其夜間尿頻給病人帶來不少麻煩,男性病人常合並前列腺肥大,可導致排尿困難,女性病人因護理不周,尿便浸漬等,可造成泌尿系統反復感染直至腎功能損害,感染,敗血癥是導致本病晚期死亡的重要原因.
5、肢體攣縮,畸形,關節僵硬等主要見於本病的晚期,故對早,中期病人應鼓勵其多運動,為晚期病人多做被動活動,以延緩肢體並發癥.
1/2 1 2 下一页 尾页