小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血百科
戈謝病(Gauchersdisease,GD)是溶酶體貯積病(lysosomalstoragedisease,LSD)中最常見的一種,為常染色體隱性遺傳.由於β-葡糖苷酶-葡糖腦苷酯酶缺乏致葡糖腦苷脂在肝、脾、骨骼和中樞神經系統的單核巨噬細胞內蓄積.其臨床特點是肝脾腫大、骨痛,Ⅱ、Ⅲ型患兒有中樞神經系統受累的表現.戈謝細胞是本癥的特征.
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血病因
(一)發病原因
GD為常染色體隱性遺傳性疾病,是由於β-葡糖苷酶-葡糖腦苷酯酶缺乏致葡糖腦苷脂在肝,脾,骨骼和中樞神經系統的單核巨噬細胞內蓄積.
(二)發病機制
溶酶體(lysosome)是一種細胞器,即細胞內的超微結構,為單層包被的囊泡,外面是一層脂蛋白膜,它是細胞的處理與回收系統,內部液體呈酸性,含有60多種酸性水解酶,可降解各種生物大分子,如核酸,蛋白質,脂質,黏多糖及糖原等,組成細胞的各種生物大分子都處於動態平衡中,不斷被分解又不斷被再合成,通過內吞作用攝入的生物大分子也需要分解成不同的組分後,才能被利用,這些大分子的分解都是在溶酶體中進行的.
溶酶體中的每一種酶皆有各自的編碼基因,每一種酶的缺陷直接導致某一特定的生物大分子不能正常降解而在溶酶體中貯積,其共同結果都是溶酶體隨之發生腫脹,細胞也變得臃腫失常,細胞功能受到嚴重影響,最終導致疾病,稱為溶酶體貯積癥(lysosomalstoragedisease,LSD).
葡糖腦苷酯酶是一種可溶性的糖脂類物質,是細胞的組成成分之一,在體內廣泛存在,正常人每克脾組織(濕重)含GC60~280µg,而GD患者可高達3~40.5mg,生理情況下,來源於衰老死亡的組織細胞的葡糖腦苷酯被單核巨噬細胞吞噬後,在溶酶體內經GBA作用水解生成葡萄糖和神經酰基鞘氨醇(ceramide),其反應式如下:
GCH20,ceramideglucose
腦組織中蓄積的GC主要來源於神經節苷脂(ganglioside),此外尚可來源於體內,如肝,腎和肌肉等各種組織,由於GBA基因突變導致體內無GBA生成或生產的GBA無活性,造成單核巨噬細胞內的GC不能被有效水解,大量GC在肝,脾,骨骼,骨髓,肺和腦組織的單核巨噬細胞中蓄積,形成典型的戈謝細胞.
戈謝病致病基因位於1號染色體,目前已經發現,許多不同的GBA點突變與發病有關,編碼GC的基因位於常染色體1q21,基因長7kb,含有8個外顯子,在此基因下遊16kb處有一高度同源的假基因,GD患者可見到錯義突變,剪接突變,轉移突變,基因缺失,基因與假基因融合等,以錯義突變最常見,導致GC的催化功能和穩定性下降,不同人種基因型的變異不同,如Ashkenzi猶太人群體中N370S最常見,僅見於Ⅰ型患者,純合子病情輕,而在亞洲人群中則無這種變異型,L444P在Ⅰ,Ⅱ和Ⅲ型患者中均可見到純合子病情重,常有神經系統癥狀,GD患者中已確定的基因突變有100餘種,中國人GD的基因型已報道10例,其中5例Ⅰ型為G46E/L444P,F37V/L444P,N188S/L444P,Y205S/L444P及R48W/R120W;2例Ⅱ型均為F213I/L444P;3例Ⅲ型為N409H/N409H,G202R/N409H及L444P/L444P,其中以L444P基因型最常見,在等位基因中占領40%,並出現在各型GD中,F37V及Y205C為中國人特有的新生突變.

小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血症状
常見癥狀
骨痛骨質疏松驚厥發紺肺受累角弓反張頸強直牙關緊閉肝功能異常肌肉萎縮
本病征由於酶缺乏的程度不同,癥狀可有較大差異,但同一傢族中發病的都有相同的類型,根據GD發病的急緩和內臟受累程度及有無神經系統癥狀將GD分三種類型:慢性型(非神經型,成人型,Ⅰ型),急性型(Ⅱ型,神經型)和亞急性型(Ⅲ型,神經型),同時根據亞急性型患者的臨床表現又再分為Ⅲa,Ⅲb和Ⅲc.
1.臨床表現
由於β-糖腦苷酯酶缺乏的程度不同,臨床表現有較大差異,生長發育落後,甚至倒退,肝脾進行性腫大,尤以脾大更明顯,肝功能異常,脾功能亢進,可有淋巴結腫大,骨和關節受累,可見病理性骨折,X線顯示骨質疏松,局限性骨破壞,股骨遠端膨大,似燒瓶樣,是典型X線征象,有些合並股骨頸骨折或脊柱壓縮性骨折,化骨核愈合較晚,門脈高壓,肺動脈高壓,肺受累有咳嗽,呼吸困難和發紺,X線胸片有肺浸潤病變,眼部可見眼球運動失調,斜視,水平註視困難,球結膜對稱性棕黃色楔型斑塊,基底在角膜邊緣,尖端指向眼眥,先見於鼻側後見於顳側,皮膚可見魚鱗病,暴露部位皮膚可見棕黃色斑,中樞神經系統受侵犯可有意識障礙,語言障礙,頸強直,角弓反張,四肢強直,剪刀腿,行走困難,全身肌肉萎縮,牙關緊閉,吞咽困難,喉痙攣,驚厥發作等,腦電圖異常.
2.臨床分型
根據各器官受累的程度,發病的急緩,以及有無神經系統受累,分為3型.
(1)Ⅰ型:慢性型又稱非神經型,最常見,尤其是猶太人種發病率高,兒童與成人均可發病,以學齡前兒童發病者多,起病緩慢,病程長,無神經系統受累癥狀,發病越早,酶活力越低,通常Ⅰ型患者GBA的活力相當於正常人的12%~45%,按病情進展可分為3期:
初期:一般狀況好,僅有脾腫大和輕度正色素性貧血,生長發育接近正常.
中期:肝臟逐漸增大,但脾臟腫大更明顯,淺表淋巴結多不腫大,隨著貧血的加重,面色逐漸蒼白,由於脾功能亢進,白細胞和血小板亦多減少,網織紅細胞輕度增高,在暴露部位和皮膚呈特殊的棕黃色,部分病人關節癥狀出現較早,可有骨和關節隱痛.
晚期:各種癥狀逐漸加重,貧血顯著,白細胞與血小板明顯減少,常合並感染和有皮膚黏膜出血傾向,淋巴結可輕度腫大,若肝臟浸潤廣泛,可出現肝功能損害,食管靜脈曲張和凝血因子的減低,尤其是Ⅸ因子缺乏較常見,骨髓浸潤時可致骨痛,關節腫痛,有時須與風濕性關節炎鑒別,兩眼球結膜可出現對稱性棕黃色楔形斑塊,基底在角膜邊緣,尖端指向眼眥,先見於鼻側,後見於顳側.
(2)Ⅱ型:急性型又稱神經型,多在1歲以內發病,最早於生後1~4周出現癥狀,病情隨起病早晚而不同,除Ⅰ型的癥狀,體征外,神經系統癥狀明顯,多在2歲以前死亡,此型的GBA活力最低,幾乎難以測出.
(3)Ⅲ型:亞急性型也稱神經型,起病較Ⅱ型緩慢,可在嬰幼兒期發病,除內臟受累外,可有1項輕,中度神經系統表現,多數在10歲左右出現,此型智力障礙較輕,智商在70左右,根據患者神經系統受累程度,又將其分為:
①Ⅲa型:有2項或以上神經系統受累表現,輕度內臟受累.
②Ⅲb型:僅有眼球運動失調,伴進行性內臟受累.
③Ⅲc型:眼球運動失調伴進行性心臟瓣膜鈣化和內臟受累.
此型患者GBA活力相當於正常人的13%~20%,對於年齡偏小的病人,可能出現神經系統癥狀較晚,故應觀察再定型.
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血检查
1.血常規可正常,脾功能亢進者可見三系減少,或僅血小板減少.
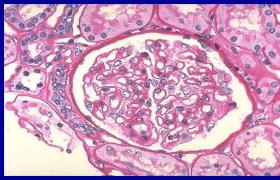
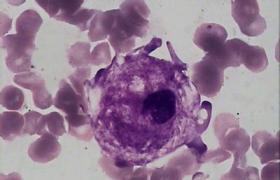
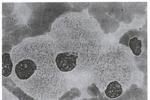
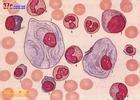
2.骨髓塗片在片尾可找到戈謝細胞,這種細胞體積大,直徑約20~80μm,有豐富胞漿,內充滿交織成網狀或洋蔥皮樣條紋結構,有一個或數個偏心核(圖1);糖原和酸性磷酸酶染色呈強陽性的苷脂包涵體,此外,在肝,脾,淋巴結中也可見到.
3.酶學檢查GC是一種外周膜蛋白,在人類細胞中常與激活蛋白SaposinC聚集在一起,當測酶活性時,需加去污劑牛磺膽酸鈉將其溶解,測患者的白細胞或皮膚成纖維細胞中GC活性可對GD做確診,此法也用於產前診斷,通過測絨毛和羊水細胞中的酶活性,判斷胎兒是否正常.
患兒父母為雜合子,其酶活性介於正常人與患兒之間,由於雜合子的酶活性與正常低限有重疊,因此不能用於雜合子的檢查.
少數GD患者酶活性正常,則應考慮為激活蛋白SaposinC的缺陷,它能增強GC水解4MU/GLC的能力.
GD患者血漿中多種酶活性升高,包括酸性磷酸酶及其他溶酶體酶,如氨基己糖苷酶,這些將支持GD的診斷.
4.皮膚成纖維細胞GC與半乳糖腦苷脂的比值正常值為0.16±0.08,Ⅰ型病人的比值降至0.04±0.02.
5.基因診斷優於酶學診斷,它是定性而酶學診斷是定量,而且標本穩定,通過突變型的分析可推測疾病的預後,如篩查L444P可確診GD,由N370S基因型患者,既是純合子,預後也好,一般無神經系統癥狀,患兒基因型確定後,其母再次妊娠時可做產前基因診斷,也可於雜合子檢出.
基因診斷可用兩步PCR法,基因型與臨床表型之間沒有確定的聯系.
6.其他應做肝功能及凝血項檢查等.
輔助檢查
1.腦電圖
患者在神經系統癥狀出現前可有腦電圖波形異常,如慢波,棘波等.
2.骨骼X線檢查
可見髓腔增寬,普遍性骨質疏松,並可見局限性骨質破壞,典型所見是股骨遠端膨大,有如燒瓶樣,常合並股骨頸骨折與脊柱壓縮性骨折,3.X線胸片可見肺內浸潤性病變.
4.其他
應做骨齡測定;腹部B超測量肝脾大小;肺功能檢查等.
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血预防
遺傳性代謝性疾病產前診斷(antenataldiagnosisofhereditarymetabolicdisease)是防止遺傳病發生的有效措施之一,是人類遺傳學知識的實際應用,是優生的重要措施,本癥確定患兒基因型後,其母再次妊娠可做產前基因診斷,也可予雜合子檢查.
羊膜腔穿刺術(amniocentesis)可於妊娠中期17~20周通過腹壁進行,羊水細胞是胎兒脫落的上皮細胞,經培養後可做酶活性測定或基因分析,此方法造成的胎兒丟失率為0.5%,至今仍然是產前診斷的一個重要手段.
絨毛來自胚胎滋養層,可於妊娠10~12周,通過腹壁吸取絨毛,可用於酶活性測定或基因分析,優點是比羊膜腔穿刺提前瞭2個月,不必培養,可較早獲得產前診斷結果,一旦胎兒患病,孕婦可及時選擇人工流產,後續操作比較容易進行,而且可早日解除孕婦的心理負擔.
產前診斷的先決條件是對先證者做出準確的診斷,母親再次妊娠時才可能在產前診斷時有目的地查某種酶或某種基因檢測,尤其產前基因診斷,除瞭缺失和用PCR/ASO方法能直接檢測出基因缺陷外,其他連鎖分析方法都以臨床診斷為前提,原因就是某些遺傳病存在遺傳異質性,同樣的疾病表型可由多個基因座突變引起,例如肌營養不良癥,較常見的是DMD/BMD,但還有其他基因突變可導致肌營養不良,如果臨床診斷不準確,用A病的多態性位點進行B病的基因診斷,勢必被引入歧途,導致診斷錯誤,其次還要避免樣品污染,胎兒材料中母源DNA的污染不容忽視,血性羊水常是導致診斷錯誤的根源之一,嚴重的血性羊水一定要通過培養去除孕婦的白細胞,絨毛采集後,一定要在倒置顯微鏡下檢查挑選,剔除子宮內膜組織.
在產前清楚判明胎兒是否患病,有的還可在孕早期做出產前診斷,在優生上具有“預防”的意義,因可在臨床上根據明確的產前診斷結果阻止胎兒出生,它不僅是惟一可行的優生措施,而且能減輕傢庭及社會的負擔,提高人口素質.
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血治疗
1.一般治療:註意患者營養的攝入.對癥治療,包括支持、輸血或輸紅細胞(貧血者).對Ⅱ型病人還需止痛(骨痛可用腎上腺皮質激素)、解痙等等.預防繼發感染.
2.脾切除:適用於巨脾,伴脾功能亢進,年齡在4~5歲以上,為瞭預防脾破裂、改善出血和感染對Ⅰ型和部分Ⅲ型GD患者建議脾切除術.但全脾切除後雖可減輕腹部負擔減輕貧血和出血傾向,改善發育狀態,預後良好.但有加速肝大及骨骼破壞的可能,故需審慎考慮.可考慮部分脾切除術.
3.酶的替代療法
(1)西利酶(ceredase):1989年國外開始使用ceredase替代治療GD,1991年正式推廣應用於臨床,至今全世界約有GD2萬~3萬人,其中已有2萬人先後接受替代治療,這對延長患者壽命、提高患者生存質量有顯著效果.經近10年的經驗總結,絕大多數病人癥狀得到改善,停止臟器繼續受累.中國自1993年5月開始為1例9歲女童GDⅢa做替代治療.1994年又為1例Ⅰ型GD男童進行治療.開始用美國GENZYME生物治療公司生產,名稱為ceredase註射劑,劑量400U/瓶(80U/ml),5ml/瓶,按60U/kg,2周推薦劑量,將藥液加入生理鹽水1~2h靜滴,最初1月每周1次,繼之每2周1次,劑量逐漸減少,半年後每4周1次.用藥後最早的療效反應為精神食欲改善,由骨痛嚴重不能下地到自由行走,治療2個月肝功能恢復,第6個月身高體重增加6~8cm,肝臟回縮1/3,腦電圖正常.1年後身高增加15cm,體重增加5kg,但骨骼X線改變不顯著,酶活性略有提高,未發現臟器受累.1999年世界健康基金會援助中國兒童基地免費提供重組GBA,治療基地,至今已有46人通過北京兒童醫院提出申請,系統接受酶替代治療.
β-葡糖腦苷酯酶的T1/2約30min,ceredase的降解速度更快.因此,酶活性雖有升高,但治療過程中有活性下降的趨勢,約5個月左右酶的活性趨於穩定,而骨的變化恢復相對較慢.反映瞭骨骼重建的速度,長期應用酶治療將能促進骨骼破壞的恢復.
(2)阿糖腦苷酶(alglucerase)註射劑:最早從人胎盤組織中提取的β-葡糖腦苷酶經過加工提取,使酶(糖蛋白)寡糖鏈上的非還原末端上富有甘露糖,這樣一來酶能被特異巨噬細胞上的碳水化合物受體所識別,才能進入單核巨噬細胞系統的溶酶體中,分解葡糖腦苷脂,以達到治療目的.時間證明此酶是安全有效的.
對Ⅱ型GD患者進行GBA替代療法對內臟、血液病變有一定效果,但algluceras不能透過血腦屏障,而改善中樞神經系統的病變,故非酶替代療法的適應證.
(3)伊米苷酶(imiglucerase):400U/瓶、200U/瓶兩種劑型,經臨床應用效果與ceredase相同.imiglucerase主要用於GDⅠ型,對Ⅲ型患者神經系統表現的療效尚未明瞭.有研究發現隻有在大劑量時,才可在腦脊液中檢測到微量GBA.但有證據表明,某些患者在接受治療後腦脊液中戈謝細胞減少,由沿水平註視困難的癥狀緩解,但對肌強直表現無改善,故對Ⅲ期GD,尤其Ⅲc型非酶替代療法的適應證.
4.基因治療國外近年開展對戈謝病基因治療的基礎與臨床研究,取得可喜的成果.應用造血祖細胞,成肌細胞移植,將GBA基因導入體內,並通過其增殖特性在體內獲得大量含有GBA基因的細胞,產生具有生物活性的GBA,起到持久治療作用.
5.骨髓移植:異基因骨髓移植治療能使酶活力上升,肝脾縮小戈謝細胞減少,但必須慎重衡量考慮手術危險性與療效.
預後
Ⅰ型GD進展緩慢,脾切除後可長期存活,智力正常,惟生長發育落後.GBA替代治療效果顯著,預後最好.Ⅰ型GD脾切除後,肝和骨髓中GC蓄積加快,故可早期死於肺和肝功能障礙,感染出血等.
Ⅱ型GD多於發病後1年內死於繼發感染,少數可存活2年以上.
Ⅲ型GD多由於神經系統癥狀較重,死於並發癥.由於GBA的應用,預後有較大的改觀.
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血饮食
飲食方面要做到規律、合理,即以高蛋白、高維生素食物為主.選擇營養價值高的植物或動物蛋白,如牛奶、蛋類、魚類、瘦肉、各種豆制品等.各種新鮮蔬菜、瓜果富含維生素,營養價值高
小兒戈謝病 小兒高歇病 小兒高歇氏病 小兒傢族性脾性貧血并发症
1.主要並發癥為脾梗死或脾破裂而危及生命.
2.合並病理性骨折,常見於股骨下端骨折,也可見股骨頸及脊柱骨折.
2/2 首页 上一页 1 2