慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病百科
慢性淋巴細胞白血病(CLL)是一種原發於造血組織的惡性腫瘤.腫瘤細胞為單克隆的B淋巴細胞,形態類似正常成熟的小淋巴細胞,蓄積於血液、骨髓及淋巴組織中.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病病因
(一)發病原因CLL病因不詳,目前尚無證據說明反轉錄病毒,電離輻射可引起該類型白血病;但發現幾種因素與該病密切相關:遺傳性(種族和傢族性)及性別.
遺傳因素(30%):
有CLL或其他淋巴系統惡性疾病傢族史者,直系親屬發病率較一般人群高3倍,CLL患者的親屬自身免疫病的發生率也明顯增加.
染色體異常(50%):
約50%的CLL患者具有染色體異常,常累及12或4號染色體,-8,i(7),i(2p),t(13;21),18,6q-,14q-,-X等異常均有報道,染色體異常與病程有關,疾病早期染色體異常占20%左右,晚期病例可達70%,CLL受累的染色體常涉及免疫球蛋白編碼基因(如14號染色體的重鏈基因)或癌基因(如12號染色體的c-ras-Harvey和11號染色體的c-ras-Kirsten).
(二)發病機制CLL的確切發病機制不明,環境因素與CLL發病無明顯相關,已報告與其他類型白血病發病有密切相關的因素如電離輻射,化學致癌物,殺蟲劑等均與CLL發病無關,病毒感染如HCV(C型肝炎病毒),EB病毒亦與CLL發病無關,雖然CLL病人中男性明顯多於女性,但未發現性激素與CLL發病之間有相關,目前研究集中在CLL發病與遺傳因素,染色體,細胞癌基因和抗癌基因改變的關系.
1.遺傳因素CLL發病率在白種人和黑種人高,在亞洲黃種人低,其發病率並不因人種的遷居而變化,提示不同種族的某些遺傳因素與CLL發病相關,此外,相繼有報告在同一個傢庭中多人發生B細胞型CLL,CLL患者第一代子女患CLL或其他惡性淋巴增生性疾病的危險性為普通人3倍,且多在年輕時發病,也提示遺傳因素在傢族性CLL發病中有重要作用,但HLA單一表型與CLL間無明顯相關,目前尚未發現與CLL發病的遺傳因子,即使單卵雙胎子CLL患者,至今未發現有共同的基因異常表現.
2.染色體CLL的細胞遺傳學研究較困難,因其淋巴細胞不易受有絲分裂原刺激而增生,不易得到分裂象細胞,近年來,通過改進刺激CLL細胞分裂技術,應用染色體R顯帶和原位雜交(FISH)法提高瞭CLL染色體研究成功率,約50%CLL患者發現有克隆染色體異常,而其餘正常核型患者可能是正常T細胞核型而未檢測到CLL的B細胞異常核型.
(1)13號染色體異常:近50%CLL患者有13號染色體長臂缺失,缺失部位多在13q12.3和13q14.3,13q12.3部位缺失,其缺失部位有乳腺癌易感基因(BRCA2),在13q14.3部位缺失,缺失部位可影響到抑癌基因RB-1(視網膜母細胞基因),DBM(與阻止淋巴細胞惡變有關),LEV1,LEV2和LEV5(與CLL發病有關).
(2)12號染色體異常:12號染色體三體型異常在CLL,初期很少檢測到,多在CLL臨床病情進展或轉為淋巴瘤(Richter綜合征)時發現伴有12號染色體三體型的CLL細胞多有復雜型改變及不典型或幼淋細胞形態,提示三體12染色體異常與CLL病情惡化有關,12染色體三體型作用機制可能是通過對位於12q13和12q22之間的某些基因如mdm基因的影響而體現.
(3)11號染色體異常:近10%~20%CLL患者有11號染色體移位或缺失,伴有11號染色體異常者臨床發病年齡較輕(<55歲),病程常表現為侵襲性,11號染色體異常可累及11q13,目前已認識到此部位包括腫瘤抑制基因-MEN-1(多發性內分泌腫瘤綜合征Ⅰ型),最常見的11號染色體缺失在11q14-24之間,特別在11q22.3-23.1之間,在此部位中可能有腫瘤抑制基因RDX(多發性神經纖維瘤Ⅱ型腫瘤抑制基因同類物)和AIM(遺傳性共濟失調-毛細胞血管擴張癥突變基因),這兩種基因的功能與激活腫瘤抑制基因p53有關,p53基因具有調節細胞周期和維持基因穩定作用,其表達產物可使異常細胞進入細胞周期時被阻滯在S1期,便於異常細胞有更多的時間進行DNA修復,如細胞不能自行修復受損的DNA,則會自行凋亡.
(4)6號染色體異常:包括6號染色體短臂及長臂異常,6號染色體短臂異常目前尚未發現有相應特定基因功能改變,6q21-q24異常患者臨床常表現為幼淋細胞增多和侵襲性病程,此外,TNF-α(腫瘤壞死因子α),和LY-α(淋巴a)其基因均位於6號染色體長臂,此兩種因子與促進CLL細胞增生,抑制正常淋巴細胞和骨髓細胞增生有關.
(5)14號染色體異常:常表現為易位,在CLL患者中少見,在淋巴瘤患者中多見t(11;14)(q13;q32)易位:在CLL中罕見,14q32含有免疫球蛋白a重鏈同型開關基因,而11q13有細胞周期素D1基因(cyclicD1)t(11;14),常見於外套型非霍奇金淋巴瘤,t(14:18)CLL患者罕見,常見於低度惡性濾泡型淋巴瘤.
3.特殊基因改變(1)p53基因:p53基因為一種重要的腫瘤抑制基因,位於17p13.1部位,編碼53-kD核酸磷酸蛋白,其突變或缺陷可能為近半數腫瘤患者的致病原因,17號染色體短臂缺失僅見於10%~15%的CLL患者,此外,還有10%~15%CLL患者有p53基因突變,伴有p53基因突變患者多為進展型,具有白血病細胞高增生率,生存期短,對一線治療藥物抵抗的臨床特點,見於半數Richter綜合征和B細胞幼淋細胞白血病,提示p53基因突變可能是某些CLL患者病程中獲得性改變.
(2)多劑耐藥基因(MDR):約40%CLL患者MDR-1基因表達增高,MDR-1位於7q21.1,編碼170kD跨膜部糖蛋白,在CLL患者B細胞中MDR-1表達增加而在正常B細胞中表達不增加,此外由於治療或其他因素也可誘導MDR-1基因表達增加,MDR基因異常表達更多是促進CLL患者病程進展原因而不是CLL原發病因.
(3)bcl-2:bcl-2基因位於染色體18q21,大多數CLL患者由於bcl-2基因重排而表達增加,約有5%左右CLL患者bcl-2基因重排是位於2號和8號染色體上的IGk或λ輕鏈基因與位於18號染色體bcl基因易位,但除基因重排外,CLL白血病細胞bcl-2表達增加與其基因位點的低甲基化有關,可能還有一些尚未瞭解的基因亦參與作用,使CLL細胞抵抗凋亡.
4.細胞因子CLL細胞具有分泌多種細胞因子的能力,如TNF-α,TGF-β(轉移生長因子β),IL-7(白介素-7),IL-5,IL-2等,這些因子具有直接或間接刺激CLL白血病細胞增生或防止CLL細胞凋亡作用,同時具有抑制正常淋巴細胞和骨髓造血有關細胞增生作用,因而細胞因子與CLL患者發病和疾病進展均相關.
細胞動力學研究顯示,CLL患者周圍血中被3H標記的白細胞數量少,提示大多數白細胞處於休止期,(G0期)而不增殖,同時發現幾乎所有的CLL的白細胞均表達高水平的抗凋亡蛋白bcl-2,及低水平的凋亡收蛋白bax,故bcl-2/bax比例失衡,致細胞凋亡受阻,符合臨床上大量成熟小淋巴細胞積聚的現象,構成CLL的主要病理基礎.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病症状
一、癥狀1、一般癥狀約1/4患者無癥狀,因檢查血常規而偶然發現.疲乏、體力活動能力下降和虛弱為常見癥狀.多在患者發生貧血或淋巴結、肝脾腫大前發生.其他少見癥狀包括CLL細胞鼻黏膜浸潤所致慢性鼻炎,感覺運動神經的多發性神經病變,對蚊蟲叮咬過敏等.在疾病的進展期,患者可有體重減輕、反復感染、出血或嚴重貧血癥狀.此外,CLL患者多為老年人,可合並有肺、心臟和腦血管疾病的表現.
2、淋巴結腫大80%的CLL患者診斷時有無痛性淋巴結腫大.最常見的部位為頸部、鎖骨上及腋窩淋巴結區.典型CLL淋巴結腫大無壓痛,但在合並感染時可有觸痛.高度淋巴結腫大可引起局部壓迫癥狀和影響器官功能,如口咽部淋巴結腫大可引起上呼吸道梗阻,腹腔淋巴結腫大可引起泌尿道梗阻和腎盂積水,壓迫膽管引起梗阻性黃疸.但CLL患者縱隔淋巴結腫大很少引起上腔靜脈綜合征.若出現此綜合征,高度懷疑合並肺部腫瘤.
3、肝脾腫大約半數CLL患者診斷時有輕度或中度肝脾腫大,常伴有飽滿感和腹脹.病程中部分患者脾大可超過臍水平,甚至延伸至盆腔,少數脾大者可伴有脾功能亢進,造成貧血和血小板減少.部分CLL患者可有肝大.肝大者肝功能異常多為輕度,多不伴黃疸.但如腹腔淋巴結腫大壓迫膽道者可產生梗阻性黃疸.
4、結外累及對CLL患者屍檢時常發現有臟器浸潤表現,但引起器官功能異常者少見.例如,一半以上患者屍檢發現腎間質有白血病細胞浸潤,但罕見腎功能衰竭者.在某些器官和組織伴有白血病細胞浸潤時可產生癥狀,如在眼球後、咽部、表皮、前列腺、性腺及淋巴組織,白血病細胞浸潤可引起突眼、上呼吸道阻塞、頭皮結節、尿道梗阻等相應癥狀.肺間質浸潤者肺X線攝片顯示結節或粟粒樣改變,可致肺功能障礙.胸膜浸潤可產生血性或乳糜樣胸腔積液.白血病細胞浸潤可致消化道黏膜增厚,產生潰瘍、出血、吸收不良.CLL中樞神經系統浸潤少見,可產生頭痛、腦膜炎、腦神經麻痹、反應遲鈍、昏迷等癥狀.
二、少見臨床表現(1)轉化為侵襲性淋巴瘤/白血病:10%~15%患者轉化為侵襲性淋巴瘤/白血病.最常見轉化為Richter綜合征,表現為進行性肝、脾、淋巴結增大、發熱、腹痛、體重減輕,進行性貧血和血小板減少,外周血淋巴細胞迅速增多.淋巴結活檢病理為大B細胞或免疫母細胞淋巴瘤.通過免疫表型,細胞遺傳學,免疫球蛋白重鏈基因重排,DNA序列分析等研究,證明有1/2Richter綜合征患者其大淋巴細胞來源於CLL的單一克隆.Richter綜合征患者對全身化療反應很差,一般生存期4~5個月.CLL還可轉為幼淋巴細胞白血病,急性淋巴細胞白血病,漿細胞白血病,多發性骨髓瘤,霍奇金淋巴瘤等.
(2)自身免疫性疾病:約20%的CLL患者可合並Coombs試驗陽性的自身免疫性溶血性貧血,其中一半患者有明顯臨床表現.2%CLL患者合並免疫性血小板減少.CLL臨床病情嚴重程度與是否合並免疫性貧血和血小板減少無相關.合並自身免疫性溶血和血小板減少患者一般對腎上腺皮質激素反應良好.對腎上腺皮質激素若無效者可試用大劑量靜脈註射丙種球蛋白、脾切除或脾區照射.
(3)純紅細胞再生障礙性貧血:有報道CLL合並純紅細胞再障患者可高達6%,臨床表現為嚴重貧血,骨髓幼紅細胞和外周血網織紅細胞減低,但不伴有粒細胞和血小板減少.腎上腺皮質激素可有短暫療效.大多數患者對化療有效,可升高血紅蛋白數值,同時伴CLL病情減輕.環孢素A並用或不用腎上腺皮質激素對合並純紅細胞再障的CLL患者也有效,但常僅為血紅蛋白量升高,CLL病情無改善.
6、繼發惡性腫瘤CLL患者可因自身免疫缺陷或化療導致繼發性惡性腫瘤.最常見為肺癌和惡性黑色素瘤,其他腫瘤有霍奇金淋巴瘤,急性髓細胞性白血病,慢性髓細胞性白血病,多發性骨髓瘤等.
1、國內診斷標準綜合近15年國內報告並參考國外文獻,CLL的診斷標準歸納修訂如下.
(1)臨床表現:
①可有疲乏、體力下降、消瘦、低熱、貧血或出血表現.
②可有淋巴結(包括頭頸部、腋窩、腹股溝)、肝、脾腫大.
(2)實驗室檢查:
①外周血白細胞10109/L,淋巴細胞比例50%,絕對值5109/L,形態以成熟淋巴細胞為主,可見幼稚淋巴細胞和不典型淋巴細胞.上述異常持續3個月.
②骨髓增生活躍或明顯活躍,淋巴細胞40%,以成熟淋巴細胞為主.
③免疫分型:B-CLL:CD5、CD19、CD20陽性;小鼠玫瑰花結試驗陽性;sIg弱陽性,呈或單克隆輕鏈型;CD10、CD22陰性.T-CLL:CD2、CD3、CD8和(或)CD4陽性;綿羊玫瑰花結試驗陽性;CD5陰性.
(3)排除其他疾病:①除外淋巴瘤合並白血病和幼淋細胞白血病;②排除病毒感染、結核、傷寒、傳染性單核細胞增多癥等其他引起淋巴細胞增多疾患者.
根據外周血及骨髓中淋巴細胞、幼稚淋巴細胞及不典型淋巴細胞的不同比例可將B細胞型慢性淋巴細胞白血病(B-CLL)分為3種類型:①典型CLL:90%以上為類似成熟的小淋巴細胞;②CLL伴隨幼淋巴細胞增多(CLL/PL):幼稚淋巴細胞10%,但50%;③混合型:有不同比例的不典型淋巴細胞,細胞體積大、核/質比例減低,胞質呈不同程度嗜堿性染色,有或無嗜天青顆粒.
2、國際診斷標準國際CLL工作會議(IWCLL)及美國國傢癌癥研究所(NCI)CLL協作組標準.
(1)外周血淋巴細胞絕對值增加5109/L,經反復檢查,至少持續4周以上(NCI),或10109/L,持續存在(IWCLL).
(2)以成熟的小淋巴細胞為主,形態分型:①典型CLL:不典型淋巴細胞10%.②LL/PL:外周血幼淋巴細胞占11%~54%.③不典型CLL:外周血中有不同比例不典型淋巴細胞,但幼淋巴細胞10%.
(3)B-CLL免疫分型:SMIg+/-,呈或單克隆輕鏈;CD5,CD19,CD20,CD23,FCM7+/-,CD22+/-.
(4)至少進行一次骨髓穿刺和活檢,塗片顯示增生活躍或明顯活躍,淋巴細胞30%;活檢呈彌漫或非彌漫浸潤.
診斷評析:患者年齡是診斷CLL的重要參數,因為95%的CLL發生在50歲以後.病史中頸部和(或)左上腹無痛性腫塊有提示價值,據此應即查血常規.如顯示白細胞總數增高,淋巴細胞絕對數5109/L,並持續存在,應高度疑似CLL,在除外引起淋巴細胞增多的其他原因後可做出基本診斷.進一步行血塗片顯微鏡下復核,如成熟的小淋巴細胞占60%以上則可確診.骨髓塗片通常和血塗片的結果是一致的,具有輔助診斷作用.骨髓病理切片可瞭解病變的程度,在核實診斷的同時,為治療方案的選擇及預後判斷提供參考依據.由於B-CLL的白血病細胞有較特異的免疫表型,對不典型病例有助於鑒別診斷.各種影像學檢查主要用於瞭解疾病范圍,不是診斷的依據.
從上述剖析中可看出,病史及體格檢查可提供診斷線索,而血液學檢測則具決定價值,免疫學檢查有輔助作用.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病检查
1.外周血(1)紅細胞:CLL病程晚期可出現貧血,最常見原因為白血病細胞浸潤骨髓引起正常造血功能抑制,在歐美國傢約20%患者合並自身免疫性溶血性貧血,在中國合並者罕見,其他原因為脾功能亢進,貧血大多為正細胞,正色素性貧血.
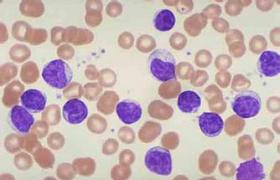
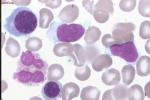
(2)淋巴細胞:CLL的外周血淋巴細胞絕對計數>5×109/L,典型患者多在(10~200)×109/L之間,最高可超過500×109/L,淋巴細胞外形與成熟小淋巴細胞相同,胞質少,胞核染色質呈凝塊狀,細胞在塗片過程中易破碎,產生典型污狀細胞.
(3)粒細胞:粒細胞比例下降,常低於40%,尤以晚期明顯,但早期粒細胞絕對計數正常或增加.
(4)血小板:血小板減少可源於白血病細胞骨髓浸潤,脾功能亢進,少數為免疫性血小板減少.
2.骨髓象骨髓檢查對於CLL診斷不是必需的,但對臨床分期預後判斷有益,增生活躍或極度活躍,淋巴細胞明顯增多,比例>40%的有核細胞數,淋巴細胞形態同血象,大多為成熟小淋巴細胞,也可有少量幼稚淋巴細胞,在病程晚期尤多見.
3.Coombs試驗陽性.
4.骨髓活檢淋巴細胞呈不同形式的浸潤,其浸潤類型與CLL患者預後直接相關:分別有以下幾種:
①骨髓間質浸潤:淋巴細胞浸潤呈帶狀,約1/3患者呈上述表現,常為早期,患者預後較好;②結節狀或結節狀與間質混合浸潤:10%CLL患者呈結節狀,25%患者呈結節狀與間質浸潤混合型,這兩種形式預後亦較好;③彌漫浸潤:25%患者淋巴細胞呈彌漫浸潤,骨髓造血細胞明顯減少,此型患者臨床上呈進展型或侵襲性,預後較差.
5.淋巴結活檢顯示淋巴結內呈與外周血相同的小淋巴細胞彌漫性浸潤,組織學上與小淋巴細胞淋巴瘤表現相同,因此,淋巴結活檢對CLL患者無診斷作用,但當淋巴結腫大原因不明時,尤其是懷疑CLL轉為Richter綜合征淋巴瘤時,應做淋巴結活檢,此時浸潤的淋巴細胞為大B淋巴細胞或免疫母細胞.
6.免疫表型用單克隆抗體和流式細胞儀可以測定CLL患者白血病細胞表面的B或T細胞分化抗原,表面免疫球蛋白,κ或λ輕鏈,不但可以鑒別CLL是T或B細胞型別,而且可以與其他易與CLL混淆的B細胞來源白血病相鑒別,CLL的B細胞免疫表型通常為CD19,CD20,CD21,CD23和CD24,大多數CLL其細胞表型為la,Fc受體和小鼠RBC玫瑰花結試驗陽性,但通常在正常B細胞具有的標志物轉鐵蛋白受體,CD22大多陰性,95%B細胞CLL呈CD5,是診斷CLL的重要指標,CD5-型CLL可能其細胞來源與CD5型不同,一般其細胞免疫表型CD22呈陽性,細胞表面IgM高水平表達,CD23弱陽性,並表達髓系標志物CD11b和CD13,骨髓呈彌漫型浸潤,臨床預後差,B-CLL與其他B細胞來源的白血病和淋巴瘤免疫表型特點.
根據臨床表現,癥狀,體征,可選擇做CT,X線,B超等檢查.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病预防
預防工作從生活中的細節開始:①、保持樂觀愉快的情緒,使大腦皮質興奮和抑制過程的平衡失調,所以需要保持愉快的心情.②、註意休息、勞逸結合,生活有序,保持樂觀、積極、向上的生活態度對預防疾病有很大的幫助.做到茶飯有規律,生存起居有常、不過度勞累、心境開朗,養成良好的生活習慣.③、合理膳食可多攝入一些高纖維素以及新鮮的蔬菜和水果,營養均衡,包括蛋白質、糖、脂肪、維生素、微量元素和膳食纖維等必需的營養素,葷素搭配,食物品種多元化,充分發揮食物間營養物質的互補作用,對預防此病也很有幫助.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病治疗
一、西醫1、治療CLL是一種預後較好的疾病,盡管尚無治愈的病例報道,但其5年生存率可達50%.20%的患者診斷時即為晚期,平均生存期約2年.治療的目的是減少並發癥,改善生存質量;一般認為早期患者可不治療,如何決定治療時機很重要,判斷標準有很多,多考慮以下幾方面:①疾病分期:一般Ⅲ、Ⅳ期(或C期)患者才考慮治療.伴貧血(尤其是出現自身免疫性溶血性貧血時)、血小板減少者需要治療.②腫塊:單純輕中度淋巴結腫大可不治療;淋巴結腫大引起功能異常時(包括神經壓迫癥狀、淋巴回流障礙導致形體改變等)需要治療.僅有脾臟腫大、無淋巴結病表現的患者預後一般較好;因此,脾腫大有癥狀者的治療應個體化.③感染:尚無確切證據表明烷化劑或皮質激素治療可減少感染的發生.④淋巴細胞計數:周血淋巴細胞計數40×109/L或淋巴細胞倍增時間長於1年者可不治療.周血淋巴細胞計數200×109/L而無其他疾病晚期表現時不一定立刻治療.
因此,CLL治療指征可歸納為出現:①貧血;②血小板減少;③脾臟進行性腫大或脾區疼痛;④淋巴結腫大,出現癥狀;⑤周血淋巴細胞計數在6個月內倍增;⑥PLL轉變;⑦Richter轉變.
CLL治療主要包括化療、放療、糖皮質激素、脾切除、骨髓移植及生物治療等.
1.化療環磷酰胺和苯丁酸氮芥(瘤可寧)是標準的一線治療藥物.苯丁酸氮芥(瘤可寧)是一種氮芥的芳香族衍生物,自1952年開始一直是治療CLL的主要藥物.口服用藥,常用劑量0.03~0.3mg/(kg·d);或總劑量0.4~0.8mg/kg,分4天用藥,每4~6周重復.二者療效相似,一般無骨髓抑制,最常見的副作用是惡心,少數可因過敏出現皮疹;有報道每天口服有繼發實體瘤的可能.完全緩解率可達15%,部分緩解率65%.Jaksic和Brugiatelli等報道每天口服大劑量苯丁酸氮芥(瘤可寧)(15mg)至緩解或出現不可耐受的毒性可取得優於CHOP方案聯合化療的效果.
環磷酰胺(CTX)效果基本和苯丁酸氮芥(瘤可寧)一樣,常用劑量為2~3mg/(kg·d)或總劑量2~3周20mg/kg,口服或靜脈用藥.苯丁酸氮芥(瘤可寧)無效者環磷酰胺(CTX)仍可有效,常用於不能耐受苯丁酸氮芥(瘤可寧)或苯丁酸氮芥(瘤可寧)無效者.副作用和苯丁酸氮芥(瘤可寧)相似,環磷酰胺(CTX)有出現出血性膀胱炎均可能.
2.聯合化療最常用的是苯丁酸氮芥(瘤可寧)+潑尼松(MP方案),常用劑量苯丁酸氮芥(瘤可寧)30mg/m2,第1天,潑尼松80mg/d,連用5天為一療程,每2周重復一次.苯丁酸氮芥(瘤可寧)可分2天用藥,根據臨床反應每月可按4mg/(m2·d)增減.白細胞計數低於10×109/L時苯丁酸氮芥(瘤可寧)應減量,使白細胞計數維持在(5~10)×109/L.苯丁酸氮芥(瘤可寧)+潑尼松的療效優於單用瘤可寧,80%的患者有效.
COP方案(環磷酰胺(CTX)、長春新堿、潑尼松)對初治患者和部分難治患者有效.劑量:環磷酰胺(CTX)300mg/(m2·d)×5天;VCR1~4mg/m2,第1天;潑尼松40mg/(m2·d)×5天;每3周重復1療程.約25%的患者可達完全緩解,50%大部分緩解;總的中位生存期4年.治療時間延長至12~18個月可以延長生存期和MP方案比較,COP方案神經毒性和骨髓抑制較重.
在COP方案的基礎上加用多柔比星(阿黴素)(2mg/m2,第1天,即CHOP方案)治療晚期患者,中位生存期可由2年延長至4年,但結果同COP方案治療18個月的患者相似.
另外,M2方案、CMP方案(環磷酰胺、氧芬胂、潑尼松)、ACP方案(阿糖胞苷、環磷酰胺、潑尼松)、DHAP方案(地塞米松、大劑量阿糖胞苷、順鉑)、MOPP方案(氮芥、長春新堿、卡鉑、潑尼松)等均有一定效果.
3.噴司他丁(DCF)噴司他丁(DCF)是一種腺苷脫氨酶抑制劑,常用劑量4mg/m2,每周或每2周靜脈用藥.有效率25%左右,主要副作用是嚴重感染.
4.氟達拉濱用藥方法有兩種:①26mg/(m2·d)×5天,28天用一療程,連用4~6療程;②20mg/m2第1天,繼30mg/(m2·d)連續輸註2天,間隔4周重復.初治患者有效率83%(完全緩解率75%),復治患者有效率12%~57%.早期患者療效較好.主要副作用是骨髓抑制和感染(感染的主要原因是CD4陽性細胞減少),另一可能的並發癥是腫瘤溶解綜合征.氟達拉濱與潑尼松聯合用藥並不改善療效,而且易出現Listeria菌感染.
5.2-chlorodeoxyadenosine(2-氯脫氧腺苷,2-CDA)2-CDA是另一種抗腺苷脫氨酶的嘌呤類藥物.常用劑量0.1g/(kg·d),連續輸註7天;或0.1mg/(kg·d),2h輸入,連用5天;口服用藥同樣有效.有效率44%,治療開始後周血淋巴細胞迅速下降者療效好.主要副作用是骨髓抑制(尤其是血小板減少)和感染(與周血CD4陽性細胞選擇性下降有關).
6.糖皮質激素單藥應用尤其適合於伴自身免疫性溶血性貧血或血小板減少者,單純CLL盡量避免單藥應用.最常用的是潑尼松,劑量30~60mg/(m2·d),逐漸減到最小量維持.開始治療時由於淋巴細胞的再分佈可出現一過性的淋巴細胞增多,用藥4~6周可觀察到周血淋巴細胞減少,部分病例可有淋巴結和脾臟縮小.主要副作用有糖尿病、骨質疏松癥、高血壓、感染等.
7.骨髓移植(1)異基因骨髓移植:異基因骨髓移植主要適用於晚期患者和化療無效者,以HLA相合的同胞供體移植為主.自診斷至移植的中位時間為3年,預處理以大劑量CTX+全身照射(TBI)為主.約75%的患者可達緩解,約40%的患者可發生急性GVHD(Ⅱ-Ⅳ度).中位無病生存期4年,移植後80個月的生存率約30%.
(2)自體造血幹細胞移植:包括自體骨髓和外周血幹細胞,預處理方案也以大劑量CTX+TBI為主;部分病例可用單克隆抗體(CD19、CD20、CD10等)凈化.由於治療病例數較少,其療效尚難得出肯定結論.
8.脾切除某些Rai分期Ⅳ期患者、嚴重血小板減少者脾切除有效.而曾用化療治療的脾功能亢進者切脾後血小板改善不明顯.
9.放療放療是最早應用於CLL的治療方法,可以改善病情,但療效維持時間較短,並常伴骨髓抑制.但目前仍不失為CLL局部治療的有效方法.
(1)全身放療(TBI):TBI的價值尚有爭議,早期的研究認為照射100~400cGy(每天5~10cGy,每周5次)部分患者可達完全緩解,並可見到血清免疫球蛋白改善.近來資料未觀察到完全緩解病例,而73%的病例可出現明顯的血液學毒性.環磷酰胺(CTX)/潑尼松加用TBI並未改善療效.
(2)局部照射:這是改善神經系統癥狀、骨痛、臟器受累、局部腫塊的重要治療手段.如照射200cGy淋巴結或包塊可以迅速縮小,但需要化療維持療效.脾區照射對身體弱,不能行脾切除術的患者也大有裨益.但縱隔照射毒性太大應慎重.
10.生物治療(1)幹擾素α-(α-IFN):早期CLL應用重組幹擾素α治療有效,可以降低淋巴細胞計數,而副作用較小.晚期患者大劑量幹擾素α治療的效果有限,而且有加重病情的危險.幹擾素可以改善化療的效果,重建自然殺傷活性.
(2)單克隆抗體:報道較少,輸註CD5鼠單克隆抗體可有短期效果;因其節節靶細胞表面抗原和有過敏反應限制瞭其應用.應用前景較大的領域是用於部分緩解或非克隆性完全緩解者,以清除微小殘留病.
(3)細胞因子:造血生長因子的應用使非移植情況下的大劑量放/化療成為可能.白細胞介素的應用正在探討中,可能有一定效果.
11.白細胞分離大量的白細胞分離可使腫大的臟器縮小,提高血紅蛋白和血小板水平.對標準化療無效的骨髓衰竭患者可選用.
2、預後CLL臨床病程異質性很大,中位生存期2~20年不等.許多臨床和實驗室特征(如臨床分期、骨髓組織病理、周血淋巴細胞計數、淋巴細胞倍增時間、淋巴細胞形態、細胞遺傳學異常等)均可影響其預後.這就要求血液腫瘤學傢尋找判斷預後的指標,其中臨床分期系統是最有價值的預後判斷參數,目前公認的CLL分期標準有兩個:等根據臨床體征和血細胞計數提出的分期和改良的含淋巴系統受累情況的分期.1987年Rai在其原來分期標準的基礎上把CLL分為三組:低危組(0期,中位生存時間150個月),中危組(Ⅰ和Ⅱ期,中位生存時間約90個月),高危組(Ⅲ和Ⅳ期.中位生存時間約19個月).
CLL可以向三個方向轉變,預後均較差.
1.幼淋細胞白血病(PLL)和CLL/PLL轉變約10%的CLL患者可向PLL轉變,這種轉變可是緩慢的,亦可是進行性的.80%的CLL患者可出現較低比例(10%)的幼淋細胞,在整個病程中該比例可以不變.約15%的患者小淋巴細胞和幼淋細胞可並存,幼淋細胞比例10%~50%不等.這部分患者診斷為CLL/PLL,其淋巴結、脾臟腫大明顯.80%的CLL/PLL患者幼淋細胞比例保持穩定,生存期和典型的CLL病程無顯著差異.
其他CLL/PLL患者可向PLL轉變,其特點是可與鼠紅細胞形成玫瑰花環的白血病細胞比例減少,外周血幼淋細胞增多,進行性脾大;部分病例可出現t(6;12)染色體改變(該染色體改變常見於PLL).發生轉變的患者化療效果差,生存期縮短,平均生存期9個月.
2.Richter轉變Richter綜合征包括發熱、體重下降、淋巴結快速腫大、肝脾腫大、伴腹部和中樞神經系統癥狀、臨床病情惡化.該轉變可發生在CLL病程的任何時間,自診斷CLL到轉變的中位時間為2年.腹膜後淋巴結腫大、巨脾常見;骨髓常有幼稚細胞浸潤,並可導致骨破壞.淋巴結活檢可確診,受累的淋巴結常顯示一類較大的原始細胞:胞質豐富、嗜堿性、核仁清晰而不規則.治療反應較差,中位生存期4個月;但也有報道,聯合化療可取得長生存.
3.ALL轉變CLL向ALL轉變很少,原始細胞可表達很強的Ig、Ia和TdT.C-myc基因和μ鏈基因表達增加.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病饮食
一、飲食多以清淡食物為主,註意飲食規律.
慢性淋巴細胞白血病 慢淋慢性淋巴細胞性白血病 慢淋 慢性淋巴細胞性白血病并发症
一、並發病癥1、感染CLL患者死亡和病情惡化的主要原因之一是感染,可累及約40%的患者.低球蛋白血癥是感染和病情惡化的主要原因之一.此外,還有粒細胞缺乏、T細胞功能異常等.最常見的是細菌感染,病毒感染(尤其是皰疹病毒感染)約占15%,真菌感染較少見.
2、繼發腫瘤9%~20%的CLL患者可繼發第2腫瘤,最常見的繼發腫瘤為軟組織肉瘤、肺癌等.CLL患者發生多發性骨髓瘤的可能性比常人增加10倍,但二者並非起源於同一惡性B細胞克隆.CLL繼發急性髓細胞白血病的危險並不增加.
1/2 1 2 下一页 尾页