呼吸窘迫綜合征 ARDS
呼吸窘迫綜合征 ARDS百科
呼吸窘迫綜合征(ARDS)包括急性呼吸窘迫綜合征和新生兒呼吸窘迫綜合征.
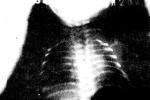
呼吸窘迫綜合征 ARDS
呼吸窘迫綜合征 ARDS病因
一、病因
ARDS是由許多原因引起的急性肺泡-毛細血管膜損傷.有些原因可直接損傷肺:如①吸入煙霧、毒氣、胃內容物及溺水;②服用過量海洛因或水楊酸鹽;③細菌、病毒及真菌等所致肺部感染;④脂肪、羊水及血栓等引起肺栓塞;以及⑤肺挫傷、放射線損傷與氧中毒等.有些全身性病理過程可引起肺損傷,如敗血癥、休克、彌散性血管內凝血、過敏反應、創傷及燒傷等.燒傷面積超過40%就可能導致Pao2明顯降低.有些治療措施也可能引起ARDS,如血液透析、體外循環、用尼龍絲去除白細胞等.
根據病因的不同及病變特點,ARDS曾有20多個名稱,如創傷後濕肺、敗血癥肺、休克肺、輸血後肺、微血管漏出綜合征,充血性肺不張、透明膜病、出現性肺綜合征、僵肺綜合癥、進行性肺實變等.
成人呼吸窘迫綜合征的病理變化
各種原因所致急性肺泡-毛細血管膜損害傷的病理變化均類似,可分為急性階段與慢性階段病變:
二、急性階段病變
主要為廣泛肺泡血管內皮和肺泡上皮損傷所致肺水腫,首先是肺間質水腫,後出現肺泡水腫,肺重可達正常值之三倍.肺泡腔內液體蛋白質含量高,甚而是血性液體,並有血細胞、巨噬細胞、細胞碎片、無定形物質、纖維蛋白條和表面活性物質的殘存物,偶而可見細胞碎片和蛋白等物質在纖維蛋白網眼中形成透明膜.
三、慢性階段病變
發病數天後進入慢性階段,病變以細胞增生為主,兩周後即可出現纖維化.Ⅱ型上皮細胞增生取代瞭變性壞死的Ⅰ型肺泡上皮細胞,加上各種細胞的浸潤使肺泡間隔增厚,肺泡腔與肺泡管內富含蛋白質的的液體機化而形成纖維化.
三、成人呼吸窘迫綜合征的發病機制
ARDS的病變主要是肺泡-毛細血管膜損傷引起肺水腫和繼後的細胞增生和纖維化.細胞增生反應和纖維化的機制和炎癥修復過程相同.故此處著重討論急性肺損傷的機制.
ARDS病人均有肺動脈高壓,故有人強調肺微血管內高壓為肺水腫的原因.但病人肺動脈楔壓往往並不高,說明毛細血管壓並不一定高.水腫液蛋白質含量豐富,動物實驗也證明,類似ARDS的動物模型肺淋巴液流量增大,肺淋巴液中蛋白質濃度與血漿蛋白質濃度之比值大於0.7;此時,靜脈註入的高分子右旋糖酐(分子量500,000)可透入肺泡液,均說明ARDS時的肺水腫主要是滲透性肺水腫,由於肺泡-毛細血管膜損傷使其通透性增高所致.
ARDS中肺泡毛細血管膜通透性增高的機制並未完全闡明.有些原始病因能直接損傷肺泡毛細血管膜使其通透性增高,如吸入胃酸、毒氣,煙熏、放射性損傷及細胞毒素作用等.大量實驗表明,更主要的是繼發性損傷,即通過白細胞和血小板在肺內聚集引起肺泡-血管膜損傷使其通透性增高.
一、中性粒細胞在ARDS發病中的作用
ARDS病人外周血液中中性粒細胞數減少.肺活檢可見肺內有中性粒細胞聚集和浸潤.支氣管肺泡洗出液中中性粒細胞可增加20~100倍.現在一般認為中性粒細胞在肺中聚集、激活、釋放氧自由基、蛋白酶和脂質代謝產物,從而導致肺微血管膜及肺泡上皮的損傷,是ARDS肺水腫的主要發病機制.
1、中性粒細胞在肺血管中聚集正常人在直立體位時約有10~20%的中性粒細胞聚集在肺毛細血管床中,這是一種物理性扣留.由於一個肺泡有近千節(segment)毛細血管,每節毛細血管長1~30μm(平均8μm),直徑1~15μm(平均5μm),一個血細胞從肺動脈流入肺靜脈要經過100個以上的毛細血管節,中性粒細胞直徑大於毛細血管口徑,其形狀與紅細胞相比更接近球形,故變形能力較差,變形速度較慢,所以中性粒細胞易被扣留在肺毛細血管床中.由於肺毛細血管床容量較大,白細胞的扣留對肺血管的阻力和肺動脈壓的影響不大.物理性扣留的中性粒細胞一般不進入肺泡腔,故正常人支氣管肺泡洗出液中的細胞90~95%是巨噬細胞.
ARDS時中性粒細胞在肺血管中的聚集是化學性粘附(adhesion),是由於趨化因子作用的結果.實驗證明,中性粒細胞經趨化因子激活後與血管內皮細胞之間的親和力顯著增強.肺泡毛細血管總面積達60m2,可粘附大量中性粒細胞,以至使外周血液中白細胞數減少.
趨化因子種類很多,主要有補體激活產物C5a、纖維蛋白降解產物(FDP),花生四烯酸代謝產物如白三烯B4(LTB4)、羥花生四烯酸(HETE)和血栓素A2(AXA2),血小板活化因子(PAF),以及其他具趨化作用的蛋白質、多肽和脂質.其中研究較多的是補體的作用.在臨床確診ARDS前8小時血漿C5a往往已升高.激活的補體本身並不直接損傷肺血管內皮細胞,它是通過激活中性粒細胞起損傷作用.給出羊灌註激活的補體可導致肺水腫,如先用氮芥使粒細胞減少後再灌註激活之補體,則肺水腫的發生明顯較經.激活的中性粒細胞可浸潤入肺間質和進入肺泡腔.ARDS病人支氣管肺泡洗出液中存在補體碎片及大量中性粒細胞.近年來發現中性粒細胞表面有一組糖蛋白,後者與粒細胞的的粘附和吞噬功能有關,它們是巨噬細胞分子-1(macrophage-1,Mac-1)淋巴細胞功能相關抗原-1(lymphocytefunctionassociatedantegen-1,LFA-1),其中Mac-1與粘附功能關系最密切.正常中性粒細胞表面僅有少量Mac-1表達,在病理情況下,趨化因子的作用使中性粒細胞表面Mac-1表達量增加,促進中性粒細胞與血管內皮細胞間的粘附.
2、中性粒細胞對肺泡-毛細血管膜的損傷動物實驗中靜脈註入內毒素、空氣等可復制急性肺微血管損傷的模型,用佛波豆蔻醚乙酸鹽(phorbolmyristateacetate,PMA)激活的中性粒細胞灌註離體肺也可使肺毛細血管通透性增高.如先用羥基脲、氮芥等使動物中性粒細胞數減少,則內毒素、空氣栓子等對肺微血管的損傷明顯減輕.細胞培養中發現,中性粒細胞秘須緊密粘附於內皮細胞才能使單層肺動脈內皮的通透性增高.以上說明減輕.細胞培養中發現,中性粒細胞必須緊密粘附於內皮細胞才能使單層肺動脈內皮的通透性增高.以上說明,中性粒細胞的粘附與激活在ARDS發病中具有重要作用,很可能是中性粒細胞激活時釋放的氧自由基、蛋白酶、脂質代謝產物和肽類物質等造成肺泡-毛細血管膜的損傷.
(1)氧自由基的作用:中性粒細胞被激活時,耗氧量急劇上升,比靜息時增加數倍至數十倍.此時細胞膜上的NADPH氧化酶(NADPhoxidase)被激活,將還原型輔酶Ⅱ(NADPH)轉變為氧化型(NADP),氧分子則獲得電子形成超氧陰離子O2-,由O2-又可生成H2O2和OH·.將正常中性粒細胞和其激活劑PMA一起灌註離體肺可引起肺水腫,水腫液蛋白質含量高;如將遺傳性慢性肉芽腫病患者的中性粒細胞與PMA灌註則不引起肺水腫,因為慢性肉芽腫病患者的中性粒細胞缺乏NADPH氧化酶、氧自由基的生成少.另外,靜脈內註射氧自由基清除劑,如超氧化物歧化酶(SOD)、過氧化氫酶、過氧化物酶、二甲本硫脲等,可減輕實驗動物的急性肺損傷.可見,中性粒細胞激活時通過釋放氧自由基引起肺損傷.
氧自由基損傷肺微血管內皮及肺泡上皮細胞的作用可能有以下幾個方面:①作用於細胞膜和細胞器膜,使其脂質過氧化,從而損害細胞膜和細胞膜的結構和功能;②作用於酶,使之失活;③作用於α1-蛋白酶抑制物,使之失活,從而增強溶酶體釋放的蛋白酶對組織的破壞作用;④作用於血漿成份,可形成一種很強的趨化物,引起更多的中性粒細胞在肺內聚集與激活,產生更多的氧自由基,由此形成陽性反饋,加重肺的損傷.
(2)蛋白酶的作用:中性粒細胞中溶酶體含有多種中性蛋白酶和酸性蛋白酶.當中性粒細胞被激活或破壞時,釋出的這些酶可引起周圍蛋白質的分解和組織結構的破壞,使肺泡-毛細血管膜的通透性增高.其中研究較多的是中性粒細胞彈性蛋白酶.例如實驗中發現,ARDS病人支氣管肺泡洗出液中彈性蛋白酶活性很高,給動物註射內毒素或油酸復制ARDS模型時,其血漿及肺泡洗出液中彈性蛋白酶含量也增多;給動物註射中性粒細胞彈性蛋白酶可引起肺血管內皮及肺泡上皮的通透性增高;組織培養中加入彈性蛋白酶導致內皮細胞分散等,說明中性粒細胞彈性蛋白酶與ARDS中的肺損傷有關.彈性蛋白酶可降解彈性蛋白、膠原蛋白、纖維連接蛋白(fibronectin,FN)等.纖維連接蛋白在內皮細胞之間和內皮細胞與基底膜之間起“錨連”作用.纖維連接蛋白受損,則血管通透性增高.
肝臟和肺泡巨噬細胞能合成α1-蛋白酶抑制物(α1-proteaseinhibitor,α1-PI),後者能抑制彈性蛋白酶.雖然ARDS病人血漿α1-PI可正常,支氣管肺泡洗出液中α1-PI活性卻降低,可能由於中性粒細胞產生的自由基使其氧化滅活所致.蛋白酶與蛋白酶抑制物間的失衡更加重瞭蛋白酶對組織的損傷,使肺泡-毛細血管膜通透性增高.
3、脂類代謝產物的作用內毒素等許多致病因素激活中性粒細胞、巨噬細胞、肥大細胞、內皮細胞等細胞膜上的磷脂酶A2,使膜磷脂裂解為花生四烯酸,後者通過環加氧酶途生成前列腺素,通過脂加氧酶途徑生成白三烯.一般認為白三烯,TXA2、和PGF2α既可收縮肺小動脈引起肺動脈高壓,也能增加肺微血管的通透性;而PGI2和PGE1則有擴張血管、降低血壓,和使血管通透性降低的作用.急性肺損傷的動物及病人肺泡洗出液及血液中TXA2、PGF2α和LTs均增多.有實驗證明PGI2和PGE1對急性肺損傷有一定的治療作用.白細胞、巨噬細胞、肥大細胞和內皮細胞等激活後還可釋放血小板活化因子(PAF).PAF可促使血小板聚集和TXA2合成,從而導致微血管通透性增高.
4、蛋白類物質的作用巨噬細胞等激活後尚可釋放蛋白類物質,其中較重要的有腫瘤壞死因子(TNF)及白細胞介素ⅠIL-1).人及動物在內毒素血癥時血漿中TNF和IL-1增多.TNF能使肺血管通透性增高,並促使中性粒細胞在肺中聚集;IL-1剌激T淋巴細胞產生白細胞介素2(IL-2),後者也可使肺血管通透性增高.
總之,現在一般認為,中性粒細胞巨噬細胞在肺內聚集、激活釋出大量氧自由基和蛋白酶及脂類代謝產物和蛋白類,引起肺泡-毛細血管膜的損傷和通透性增高,導致肺水腫,這是ARDS的主要發病機制.雖然有報導白細胞減少的病人患敗血癥時也可發生急性肺損傷,用藥物使動物中性粒細胞減少對註油酸引起肺損傷並無明顯影響,但這些事實並不足以否定中性粒細胞的致病作用,因為外周血液中的中性粒細胞數不一定能反映肺循環中的粒細胞數.而且究竟需要多少中性粒細胞激活就足以引起急性肺損傷尚不瞭解,也可能正常聚集在肺血管中的中性粒細胞隻有一部分被激活就足以損傷肺而導致ARDS.
二、凝血系統在ARDS發病中的作用
ARDS病人肺活檢及死後屍解發現,肺小動脈血栓可發生於肺充血、水腫、出血及透明膜的形成之前.ARDS病人合並有彌散性血管內凝血者,其低氧血癥和肺順應性降工遠較未合並DIC者為重,中性粒細胞激活和肺組織損傷所釋放的促凝物質,肺血管內皮損傷和血液停滯,可導致血小板聚集和血管內凝血形成微血栓.肺內廣泛微血栓形成可能引起:①肺循環阻力增加使肺動脈壓升高,未堵塞的肺血管則血液量增大和毛細血管壓升高,導致壓力性肺水腫;②血栓損傷血管壁和血小板釋放的血管活性物質以纖維蛋白降解產物,可使血管通透性增高致滲透性肺水腫;③血小板的消耗、纖維蛋白降解產物的抗凝作用、和血管壁的損傷可引起肺內出血;④血小板釋放的5-HT等介質使支氣管收縮,影響肺通氣.近年特別引人註目的是纖維蛋白降解產物(FDP)的作用,發現嚴重創傷燒傷或感染病人中,已合並ARDS者血中FDP水平比未發生ARDS者高得多,而且ARDS病情與FDP濃度有一定平行關系.將纖維蛋白碎片D(FD)註入傢兔血管,可引起進行性外周血液血小板減少、肺間質內白細胞浸潤,肺血管通透性增高和肺功能不全;如註入血漿白蛋白、纖維蛋白及纖維蛋白碎片E,則不出現以上病變.很可能小板上有FD特異的膜受體,後者與FD結合可激活血小板,引起血小板聚集和釋放反應.另外,FD也是趨化物,能促使中性粒細胞在肺內聚集、粘附和激活,由此加重肺的損害.
正常肺毛細血管內皮的通透性比肺泡上皮高10倍.ARDS中肺毛細血管通透性的變化早於肺泡上皮,故先發生肺間質水腫,後出現肺泡水腫.肺泡上皮的損傷使Ⅱ型上皮細胞生成的表面活性物質減少,可導致肺不張,形成功能性分流.
在全身性病理過程如敗血癥、休克等,中性粒細胞粘附於血管內皮以及血管內凝血引起的組織損傷,不僅發生於肺內,也可發生於肝、腎、腸、心、內分泌器官等處,故不能把ARDS看成僅僅是肺的損傷.但肺的血流量最大,毛細血管床面積也最大,故肺受累最重,使病人主要表現為急性呼吸衰竭.
四、成人呼吸窘迫綜合征時肺呼吸功能變化
ARDS所致外呼吸功能障礙以肺泡通氣-血流比例失調為主,加上彌散功能障礙,表現為低氧血癥性呼吸衰竭.極嚴重病例有總的肺泡通氣量減少時可出現高碳酸血癥性呼吸衰竭.
一、肺泡通氣-血流比例失調
由於Ⅱ型肺泡上皮細胞受損致表面活性物質的生成減少,肺泡水腫使表面活性物質被稀釋和破壞,和肺泡過度通氣引起的表面活性物質消耗,以致肺泡表面張力升高,肺順應性降低,導致肺不張,由此形成功能性分流和真性分流.中性粒細胞等釋出的白三烯等介質使支氣管收縮,和水腫液堵塞小氣道,氣可造成肺通氣障礙而形成功能性分流.ARDS病人分流量可達肺血流量的30%.肺血管內微血栓形成、血管活性物質引起不均勻的肺血管收縮、以及肺間質水腫對血管的壓迫,不僅可增加肺血管阻力使肺動脈壓升高.尚可增加死腔樣通氣.因此,肺泡通氣-血流比例失調是病人發生呼吸衰竭最主要的原因.
四、彌散功能障礙
肺間質和肺泡水腫、透明膜的形成和慢性階段細胞的增生及肺纖維化,均可增加彌散膜的厚度,導致彌散功能障礙.
五、肺泡通氣量減少
ARDS時肺部病變的分佈是不均的.肺順應性降低引起的限制性通氣障礙和小氣道阻塞引起的阻塞性通氣障礙,造成部分肺泡通氣量減少,未受累或病變較輕的肺泡反而代償性通氣增強,排出過多的二氧化碳,故病人Paco2反而降低.當肺泡-毛細血管膜損傷更廣泛更嚴重時,全肺總的肺泡通氣量將減少,CO2將瀦留而發生高碳酸血癥,此時Pao2將進一步下降.
肺通氣障礙、Pao2降低對血管化學感受器的剌激、肺充血和肺水腫對J感覺器的剌激,導致病人呼吸窘迫.[J感受器(juxtapulmonarycapillaryreceptor)位於肺泡毛細血管旁,能感受毛細血管壓力剌激,肺充血、肺水腫受剌激反射性地引起呼吸加快.
呼吸窘迫綜合征 ARDS
呼吸窘迫綜合征 ARDS症状
臨床表現
除原發病如外傷、感染、中毒等相應癥狀和體征外,主要表現為突發性、進行性呼吸窘迫、氣促、紫紺、常伴有煩躁、焦慮表情、出汗等.其呼吸窘迫的特點不能用通常的療法使之改善,亦不能用其他原發心肺疾病(如氣胸、肺氣腫、肺不張、肺炎、心力衰竭)解釋.
診斷
至今由於缺乏特異的檢測指標,給早期早期帶來困難.凡有可能引起ARDS的各種基礎疾病或誘因,一旦出現呼吸改變或血氣異常,均應警惕有本征發生的可能.建立診斷綜合臨床、實驗室及輔助檢查,必要的動態隨訪觀察,並排除類似表現的其他疾病.為疾病統計和科研需要,必須依據確定的診斷標準.歷年來曾有各傢提出的各種診斷標準,差別甚大.歐美學者在1992年分別在美國和歐洲的學術會議上商討、1992年同提出、並在1994年各種雜志發表的關於ALI和ARDS定義和診斷標準,最近在我國被廣泛介紹和推薦.
ARDS診斷標準
除規定PaO/FiO≤26.7kPa(200mmHg)外,其餘指標與ALI相同.
1995年全國危重急救學學術會議(廬山)仿照上述標準提出我國ARDS分期診斷標準如下:
1、有誘發ARDS的原發病因.
2、先兆期ARDS的診斷應具備下述5項中的三項:
⑴呼吸頻率20~25次/分.
⑵(FiO20.21)PaO2≤9.31kPa(≤70mmHg),>7.8kPa(60mmHg)
⑶PaO2/FiO2≥39.9kPa(≥300mmHg)
⑷PA-aO2(FiO20.21)3.32~6.65kPa(25~50mmHg)
⑸胸片正常.
3、早期ARDS的診斷應具備6項中3項.
⑴呼吸頻率>28次/分.
⑵(FiO20.21)PaO2≤7.90kPa(60mmHg)>6.60kPa(50mmHg)
⑶PaCO2<4.65kPa(35mmHg)
⑷PaO2/FiO2≤39.90kPa(≤300mmHg)>26.60kPa(>200mmHg)
⑸(FiO21.0)PA-aO2>13.30kPa(>100mmHg)<26.60kPa(<200mmHg)
⑹胸片示肺泡無實變或實變≤1/2肺野.
4、晚期ARDS的診斷應具備下述6項中3項:
⑴呼吸窘迫,頻率>28次/分.
⑵(FiO20.21)PaO2≤6.60kPa(≤50mmHg)
⑶PaCO2>5.98kPa(>45mmHg)
⑷PaO2/FiO2≤26.6kPa(≤200mmHg)
⑸(FiO21.0)PA-aO2>26.6kPa(>200mmHg)
⑹胸片示肺泡實變≥1/2肺野.
呼吸窘迫綜合征 ARDS
呼吸窘迫綜合征 ARDS检查
一、檢查
早期體征可無異常,或僅聞雙肺幹囉音、哮鳴音,後期可聞及水泡音,或管狀呼吸音.
X線胸片早期可無異常,或呈輕度是間質改變,表現為邊緣模糊的肺紋理增多,繼之出現斑片狀,以至融合成大片狀浸潤陰影,大片陰影中可見支氣管充氣征.
二、鑒別
本病須與大片肺不張、自發性氣胸、上呼吸氣道阻塞、急性肺拴塞和心源性肺水腫相鑒別,通過詢問病史、體檢和胸部x線檢查等可作出鑒別.心源件肺水腫患者臥位情時呼吸困難加重.咳粉紅色泡沫樣痰,雙肺底有濕哆音,對強心、利尿等治療效果較好;若有困難,可通過測定PAwP、超產心動閣檢查來鑒別.
呼吸窘迫綜合征 ARDS预防
對高危的患者應嚴密觀察,加強監護,一但發現呼吸頻速PaO2降低等肺損傷表現,在治療原發疾病時,應早期給予呼吸支持和其它有效的預防及幹預措施,防止ARDS進步發展和重要臟器損傷.
ARDS的預後除與搶救措施是否得當有關外,常與患者原發病並發癥以及對治療的反應有關,如嚴重感染所致的敗血癥得不到控制則預後極差.骨髓移植並發ARDS死亡率幾乎100%.若並發多臟器功能衰竭預後極差,且與受累器官的數目和速度有關,如3個臟器功能衰竭,持續1周以上,病死率可高達98.%經積極治療後,若持續肺血管阻力增加,示預後不良脂肪栓塞引起的ARDS,經積極處理,機械通氣治療可獲得90%存活.刺激性氣體氣體所致的急性肺水腫和ARDS,一般脫離現場,治療及時,亦能取得較好的療效.另ARDS患者若經PEEP0.98(10cmh20)治療後,PaO2明顯上升預後較好.ARDS能迅速得到緩解的病人,大部分能恢復正常.在40%肺功能異常的ARDS恢復者中,20%示阻塞性通氣損害、30%彌散量降低、20%運動時PaO2下降.
呼吸窘迫綜合征 ARDS治疗
一、西醫
1、治療原發疾病
消除ARDS的原因,如抗感染、抗休克治療等.
二、吸氧與呼氣末正壓呼吸
ARDS病人發生低氧血癥的主要機制是肺內功能性分流,所以吸氧療法對提高其Pao2的作用較小.吸呼高濃度氧可提高Pao2,但吸入氧濃度在60%以上2~3天就可能引起氧中毒,反而加重ARDS.
呼氣末正壓(positiveendexpiratorypressure,PEEP)呼吸使呼氣末時氣道及肺泡壓大於大氣壓,可將原來萎陷的氣道和肺泡張開,恢復其氣體交換功能,從而減少肺內分流,提高Pao2用PEEP呼吸尚可降低吸入氣的氧濃度.但呼氣末壓力過高會壓迫肺血管和心臟,使心輸出量減少,導致循環性缺氧.
三、維持液體平衡,控制肺水腫
如適當限制入水量、利尿等.
四、用藥物減輕肺泡-毛細血管膜的損傷和降低膜通透性
針對肺泡-毛細血管膜損傷的機制,采用相應的藥物進行發病學治療,有的已取得一定療效,有的還處於實驗階段.曾試用的藥物有:抗氧化劑(如超氧化物歧化酶)、蛋白酶抑制劑、磷脂酶A2抑制劑(如阿的平)、TXA2合成酶抑制劑(如咪唑)、脂加氧酶抑制劑(如U-60,257)、肝素和右旋糖酐、C5a及TNF的抗體、鈣通道阻滯劑(如戊脈安)、其他擴血管藥(如腺苷)、PGE和PGI2、以及腎上腺皮質激素等.
呼吸窘迫綜合征 ARDS饮食
成人呼吸窘迫綜合癥吃哪些食物對身體好?
註意營養供應,補充足夠能量
呼吸窘迫綜合征 ARDS并发症
急性呼吸窘迫綜合征患者病後不久,數天或數周後病情未得緩解時,可由於氧供不足引起出現其他器官的並發癥.缺氧時間過長可引起嚴重的並發癥如腎功能衰竭,如未獲及時治療,可因嚴重缺氧而死亡.由於急性呼吸窘迫綜合征患者防禦肺部感染的能力低下,在其患病過程中常常出現細菌性肺炎.
1/2 1 2 下一页 尾页