幽門螺桿菌感染 幽門螺旋桿菌感染
幽門螺桿菌感染 幽門螺旋桿菌感染百科
幽門螺桿菌是一種螺旋狀、革蘭陰性、微需氧性細菌.人群中幾乎一半終身感染,感染部位主要在胃及十二指腸球部.早在1893年,Bizzozero報道在狗的胃內觀察到一種螺旋狀微生物.之後,Kreintz和Rosenow在人胃內也發現瞭螺旋體.1979年,Warren發現慢性胃炎和消化性潰瘍患者的多數胃黏膜活檢標本上定居有彎曲菌樣的細菌,有規律地存在於黏膜細胞層的表面及黏液層的下面,易於用Warthin-Starry飽和銀染色法染色.直到1983年,Marshall及Warren用彎曲菌的微氧培養方法,首次報道成功分離出瞭這種細菌.從此引起醫學屆廣泛興趣和深入研究.以後發現此菌許多特征與彎曲菌屬相似,而命名為“幽門彎曲菌(Campylobacterpylori,CP)”.
幽門螺桿菌感染 幽門螺旋桿菌感染
幽門螺桿菌感染 幽門螺旋桿菌感染病因
一、發病原因
Hp革蘭染色陰性,常作S形或弧形彎曲,有1~3個螺旋,長2.5~4.0μm,寬0.5~1.0μm,延長培養時間或藥物治療後,常呈類球形.菌體兩端鈍圓,菌體的一端或兩端有2~6條帶鞘的鞭毛,鞭毛長約為菌體的1.0~1.5倍,粗約為30nm,各有著毛點,著毛點不內陷,鞭毛末端呈圓球狀或卵圓形.細胞壁光滑,與上皮細胞膜緊密相貼.在鞭毛根部內側的細胞質末端有一明顯的電子密度降低區,可能與鞭毛運動的能量貯存有關.貓胃螺桿菌(Helicobacterfelis,Hf)和海爾曼螺桿菌(Helicobacterhelimannii,Hh)均為3~12個緊密的螺旋,與Hp極易區別.人胃活檢標本分離的Hp菌株有多樣性基因表型,至少可分為兩大類型:Ⅰ型為有細胞毒相關基因A(cytotoxinassociatedgeneA,CagA),表達CagA蛋白及空泡毒素(vaculatingcytotoxinA,VacA);II型無CagA,既不表達CagA蛋白,也不表達VacA.Hp是一種專性微需氧菌,其穩定生長需依靠在生長的微環境中含5%~8%的氧氣,在大氣和絕對厭氧環境中均不能生長.Hp生長緩慢,通常需3~5天,才能形成針尖狀小菌落(0.5~1.0mm).能產生尿素酶、過氧化氫酶、脂酶、磷脂酶和蛋白酶.細菌對外環境的抵抗力不強,對幹燥及熱均很敏感,多種常用消毒劑很容易將其殺滅.
二、發病機制
Hp進入人胃內低pH環境中,能生長繁殖,並引起組織損傷,其致病作用主要表現為:細菌在胃黏膜上的定值,侵入宿主的免疫防禦系統、毒素的直接作用及誘導的炎癥反應和免疫反應.
1.Hp的定值Hp的自然定植部位在胃黏膜上皮表面和胃黏液底層,呈點狀分佈,胃竇部數量多,胃體和胃底較少.Hp亦可定植於十二指腸的胃黏膜化生區、Barrett食管和梅克爾憩室等異位胃黏膜處.Hp進入胃後要到達黏膜表面和黏液底層定植,除要抵抗胃酸和其他不利因素的殺滅作用外,還要依靠動力穿透黏液層.其螺旋狀菌體,為Hp在黏稠的胃黏液中運動提供瞭基礎;而其鞭毛的擺動則為Hp的運動提供瞭足夠的動力.Hp產生的尿素酶能將尿素分解為氨和二氧化碳,氨在Hp周圍形成“氨雲”,中和胃酸保護Hp.產生的超氧化物歧化酶(SOD)和過氧化氫酶能保護其不受中性粒細胞的殺傷.另外,還產生多種黏附因子,使其能緊密地黏附於胃上皮表面.
2.損害胃及十二指腸黏膜Hp的毒素和有毒性作用的酶以及Hp誘導的黏膜炎癥反應均能造成胃和十二指腸黏膜屏障的損害.
(1)Hp的毒素:約60%Hp菌株能產生有活性的空泡毒素(VacA,87kda),使上皮細胞產生空泡變性.VacA的表達及毒性強弱與VacA基因型和細胞毒相關基因蛋白(CagA,128kda)有關,這是Hp菌株致病性差異的重要原因,其中VacAs1/m1基因型毒素活性最強,Vacs2/m2基因型無毒素活性.
(2)Cag致病島:1996年,Censini等發現Hp菌株含有一個約40kb的特殊基因片段,呈現於致病相關菌株,且有細菌至病島的典型結構特征,因此稱為Hp的Cag致病島.研究顯示Cag致病島與VacA的產生、與Hp對胃上皮細胞表面Leb抗原受體的結合能力、與參與細胞骨架重排的肌動蛋白等相關.
(3)尿素酶:尿素酶除瞭對Hp本身起保護作用外,還能造成胃黏膜屏障的損害.一是尿素酶分解尿素產生氨的直接細胞毒作用;二是尿素酶可誘導胃上皮細胞及中性粒細胞表達分泌白細胞介素-6(IL-6),腫瘤壞死因子-α(TNT-α)等炎癥介質.
(4)Hp的蛋白酶、脂酶和磷脂:均能破壞胃黏液層的完整性,增加黏液的可溶性和降低其疏水性,進而降低瞭黏液對上皮細胞的保護作用.
(5)致炎因子:Hp表面及分泌的可溶性成分和趨化蛋白能趨化激活中性粒細胞、單核細胞和巨噬細胞,產生TNF-α、白細胞三烯、IL-1和IL-2,並進一步加強IL-8的激活反應,促進黏膜的炎癥損傷.
(6)胃腸道激素:多數文獻證實Hp感染者生長抑素釋放減少、胃泌素釋放增加.從而導致高胃酸分泌,加重胃十二指腸黏膜酸負荷;胃泌素促進黏膜細胞增生,與腫瘤形成可能有關.
(7)免疫反應:Hp感染誘導產生特異性細胞和體液免疫,並誘發機體的自身免疫反應,損害胃腸黏膜.黏膜損傷後,從炎癥到癌變的過程可能是:慢性胃炎→萎縮性胃炎→腸上皮化生→不典型增生→癌變.最近研究提示根除Hp後可以阻止這一過程的發展.
幽門螺桿菌感染 幽門螺旋桿菌感染
幽門螺桿菌感染 幽門螺旋桿菌感染症状
感染Hp後大多數患者表現隱匿,無細菌感染的全身癥狀,也常無胃炎的急性期癥狀,臨床上患者往往以慢性胃炎,消化性潰瘍等表現就診,從吞食活菌自願者試驗結果可見,感染先引起急性胃炎,未治療或未徹底治療,而發展為慢性胃炎,急性感染潛伏期2~7天,胃鏡下表現為胃竇急性充血糜爛,組織學檢查黏膜層有充血,水腫及中性粒細胞浸潤,癥狀可表現為腹痛,腹脹,晨起惡心,反酸,噯氣,饑餓感,重者出現嘔吐,現已有足夠證據表明,Hp是引起慢性胃炎的主要原因,慢性胃炎Hp檢出率54%~100%,慢性活動性胃炎Hp檢出率為90%以上,不僅引起胃竇炎,也可引起胃體底炎.
幽門螺桿菌感染 幽門螺旋桿菌感染
幽門螺桿菌感染 幽門螺旋桿菌感染检查
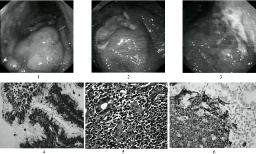
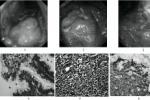
1.細菌培養直接將胃黏膜標本劃種到固體培養基上或將胃黏膜標本研磨成勻漿後接種,置微氧條件下,相對濕度90%以上,37℃孵育48~72h後觀察結果,至少依據塗片染色鏡檢,尿素酶,過氧化氫酶及氧化酶鑒定.
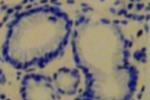
2.胃活檢黏膜塗片將活檢黏膜面直接塗抹於清潔玻片上,自然幹燥後革蘭染色或復紅染色,油鏡觀察.
3.組織切片染色胃黏膜活檢標本(宜多點取材)垂直包埋切片,采用Warthin-Starry和Centa銀染色或HE染色,Giemsa染色,熒光素吖啶橙染色,米帕林染色以及無標記抗體PAP染色等在油鏡下或熒光顯微鏡下觀察.
4.尿素酶試驗Hp具高度尿素酶活性,能分解尿素產生NH+4,通過測NH+4存在與否,間接判斷有否Hp感染,有pH指示劑法,分析化學法和同位素標記尿素試驗等方法.
5.14C尿素呼氣試驗給患者口服14C尿素,如有Hp感染,20min後患者呼出的氣體中有14CO2,無Hp感染則無14CO2呼出,此試驗安全,準確,重復性好,但因設備等原因不易推廣應用.
6.血清學檢查應用ELISA方法檢測血清或唾液中的抗HpIgG或抗HpIgA,為特異性和敏感性指標.
7.聚合酶鏈反應(PCR)技術可檢測胃液,胃黏膜,唾液中Hp,陽性率高於尿素酶法.
8.原位鑒定可應用單克隆抗體進行免疫組織化學檢測,Hp特異探針或引物進行原位雜交及PCR檢測.
組織切片染色:胃黏膜活檢標本(宜多點取材)垂直包埋切片,采用Warthin-Starry和centa銀染色或HE染色,Giemsa染色,熒光素吖啶橙染色,米帕林染色以及無標記抗體PAP染色等在油鏡下或熒光顯微鏡下觀察.
幽門螺桿菌感染 幽門螺旋桿菌感染预防
鑒於Hp感染的傳染來源和傳播途徑尚不十分明瞭,因此給預防Hp感染帶來瞭困難,從20世紀90年代以來,Hp疫苗的研究取得瞭較大進展,可以預期在不久的將來,通過疫苗防治Hp感染將變為現實,也可能是今後Hp相關性疾病防治的重要措施.
幽門螺桿菌感染 幽門螺旋桿菌感染治疗
鑒於Hp感染的傳染來源和傳播途徑尚不十分明瞭,因此給預防Hp感染帶來瞭困難.從20世紀90年代以來,Hp疫苗的研究取得瞭較大進展,可以預期在不久的將來,通過疫苗防治Hp感染將變為現實,也可能是今後Hp相關性疾病防治的重要措施.
(一)治療
隨著人們對Hp感染相關疾病認識的統一,根除(eradication)Hp的治療在臨床上應用已十分普遍.根除是指治療結束1個月後胃內檢測不到Hp.在體外藥敏試驗中,很多抗生素對Hp有良好的抗菌活性,但在體內低pH環境中,大多數抗生素活性降低和不能穿透黏液層在細菌局部達到有效的殺菌濃度,因此臨床上Hp感染往往不易根除.迄今為止,尚無單一抗生素能夠有效地根除Hp.因而發展瞭將抗生素、鉍劑及抗分泌藥物聯合應用的多種治療方案.目前一般采用三聯或四聯方案,以低劑量、短療程為佳.
1.根除Hp治療指征
Hp陽性的下列疾病均根除Hp治療.
(1)消化性潰瘍,不論潰瘍初發或復發、活動或靜止、是否並發出血.
(2)胃MALT淋巴瘤.
(3)胃炎伴糜爛、腸化生、不典型增生等嚴重異常.
(4)早期胃癌切除術後.
2.根除Hp治療方案
目前根除Hp的治療方案有二大類,即以質子泵抑制劑(PPI)為基礎和以膠體鉍(CBS)為基礎加二種抗菌藥物的三聯療法.PPI標準劑量為奧美拉唑(omeprazole,洛賽克)20mg或蘭索拉唑(lansoprazole,達克普隆)30mg;鉍劑標準劑量為枸櫞酸鉍鉀(胃瘍靈)240mg(膠囊2粒).常用抗菌藥物有阿莫西林、克拉黴素、甲硝唑或替硝唑、呋喃唑酮及四環素.全國Hp專傢推薦下列幾種治療方案,供臨床選用:
(1)以PPI為基礎三聯七天療法:
①OMC250:奧美拉唑20mg+甲硝唑400mg+克拉黴素250mg,均服2次/d,療程7天.
②OAC500:奧美拉唑20mg+阿莫西林1000mg+克拉黴素500mg,均服2次/d,療程7天.
③OAM:奧美拉唑20mg+阿莫西林1000mg+甲硝唑400.mg,均服2次/d,療程7天.
(2)以CBS為基礎三聯十四天或七天療法:
①BMA:膠體鉍240mg+甲硝唑400mg+阿莫西林500mg,均服2次/d,療程14天.
②BMT:膠體鉍240mg+甲硝唑400mg+四環素500mg,均服2次/d,療程14天.
③BFC250:體鉍240mg+呋喃唑酮100mg+克拉黴素250mg,均服2次/d,療程14天.
④BMC250:體鉍240mg+甲硝唑400mg+克拉黴素250mg,均服2次/d,療程7天.上述三聯療法為目前臨床常用的一線治療方案,Hp根除率可達到80%~90%.如因經濟原因可將PPI三聯療法中的PPI換為H2受體拮抗劑(H2RA),但療效略差.如一線方案治療失敗或Hp對甲硝唑、克拉黴素耐藥時,可選用PPI加上鉍劑為基礎的三聯療法組成四聯療法,即所謂二線方案,療程7天,既可克服Hp耐藥又可提高根除率,其Hp根除率≥90%.近年來提出選用雷尼替丁/枸櫞酸鉍(RBC)兩種抗生素組成治療方案,對Hp根除率達94%以上,優於其他療法.根除Hp治療時由於用藥較多,部分藥物副作用大,因此臨床治療時應密切註意患者的不良反應和依從性,以保證療效.
(二)預後
一般預後良好,有並發癥者預後欠佳.
幽門螺桿菌感染 幽門螺旋桿菌感染饮食
多吃豆類食物,多飲茶,少吃辛辣食物,可免遭HP的感染.
飲食註意事項
1、幽門螺桿菌感染往往有傢庭聚集性,為根除徹底和避免再感染,治療時傢庭中的其他人員最好也要同時治療,並實施分餐制,以免再度感染.
2、註意飲食定時定量,營養豐富,食物軟爛易消化,少量多餐,細嚼慢咽,忌過飽,忌生冷酸辣、油炸刺激的食物,忌煙熏、醃制食物.含亞硝胺的醃制食品等也具有致癌作用,加上幽門螺桿菌的作用,就會增加癌變的幾率.
3、防止病從口入,不吃不潔食物.
4、養成良好的衛生習慣,飯前便後洗手.
幽門螺桿菌感染 幽門螺旋桿菌感染并发症
胃出血:粘膜萎縮變薄、血管顯露、粗糟食物磨搓、粘膜糜爛出血,以黑便為主要表現,若出血量大時可突然吐血,重者頭暈,心慌、眠黑、大汗、甚至休克等.
1/2 1 2 下一页 尾页